介绍
干细胞是一群未分化的细胞,具有自我更新和重建功能组织的独特能力。它们主要根据分化潜力、起源和谱系进展进行分类。
根据其效力,干细胞可以是全能的、多能的、专能的、寡能的和单能的。干细胞存在于胚胎和成体细胞中。胚胎干细胞 (ESC) 和诱导多能干细胞 (iPSC) 是多能干细胞的最佳例子,而成体多能干细胞的例子有造血干细胞 (HSC)、间充质干细胞 (MSC)、神经干细胞(NSC)和内皮干/祖细胞(EPC)(图1a)。所有这些干细胞亚型都已被广泛试验用于治疗人类疾病。

外泌体的产生和纯化(MSC和NSC用作多能干细胞的例子)。b天然外泌体的含量。c外泌体修饰。(BM骨髓、DC树突状细胞、IAC免疫亲和层析、iPSC诱导多能干细胞、MHC主要组织相容性复合物、miRNA microRNA、MSC间充质干细胞、MVB多泡体、NSC神经干细胞、SEC尺寸排阻层析、UC脐带)
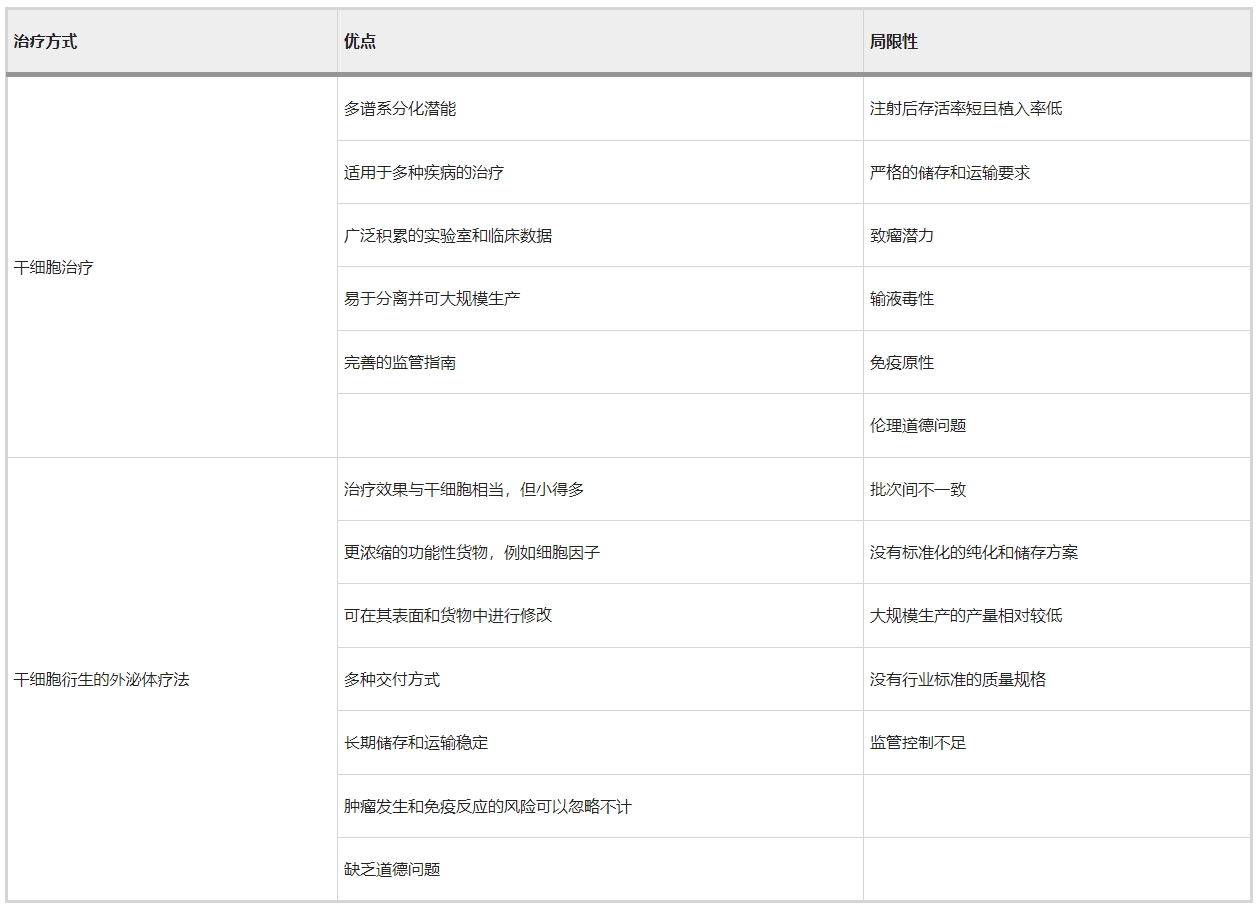
干细胞疗法作为再生医学的一种方式,引起了极大的关注,因为它为患有以前无法治愈的疾病的患者提供了新的选择。随后,数千项相关临床试验被注册,涵盖广泛的医学问题,如肌肉骨骼和神经系统疾病、免疫疾病、血液功能障碍和退行性疾病。然而,一些试验未能在临床中显示出任何益处。这可能是由于干细胞疗法不可避免的局限性,例如输注毒性、免疫原性、致瘤潜力和伦理问题。外泌体由包括干细胞在内的几乎所有细胞类型分泌(图1a),已被认为是干细胞治疗的更安全、更通用的替代方案。
外泌体是纳米级、球形、脂质双层单膜细胞外囊泡,充当细胞间信使。外泌体被认为是其亲代细胞的微型版本,部分原因是来自某种细胞类型的外泌体提供了细胞特异性或独特的生物分子组。此外,还发现干细胞通过其可溶性分泌体(包括外泌体)以旁分泌方式发挥作用。
换句话说,干细胞衍生的外泌体 (SC-Exo) 从其亲本细胞继承了类似的治疗作用,例如抗炎、免疫调节和组织再生。总的来说,干细胞来源的外泌体是干细胞治疗的有效替代品,且没有表现出其细胞对应物所存在的缺点(表1)。
在临床应用之前,必须在生产、纯化和修饰方面制备和优化外泌体(第2.3和2.4节)。近年来,发表了大量分析外泌体治疗上游措施的医学评论。然而,一些研究途径仍然没有得到充分研究:特别是缺乏致力于下游临床应用的系统研究,特别是从外科角度来看。无论是由于疾病还是外科医生的手术刀而受损的组织,都会通过炎症和再生动力学做出反应,使手术成为干细胞衍生的外泌体治疗的完美场所。干细胞衍生的外泌体从其亲本细胞继承了类似的治疗作用,例如组织再生、抗炎和免疫调节。
在这项工作中,我们将剖析过去五年的相关出版物,以呈现全面的、最新的、针对特定专业和疾病的综述(图2)。我们的目标是弥合外科医生、纳米医学从业者和干细胞研究人员之间目前存在的差距。
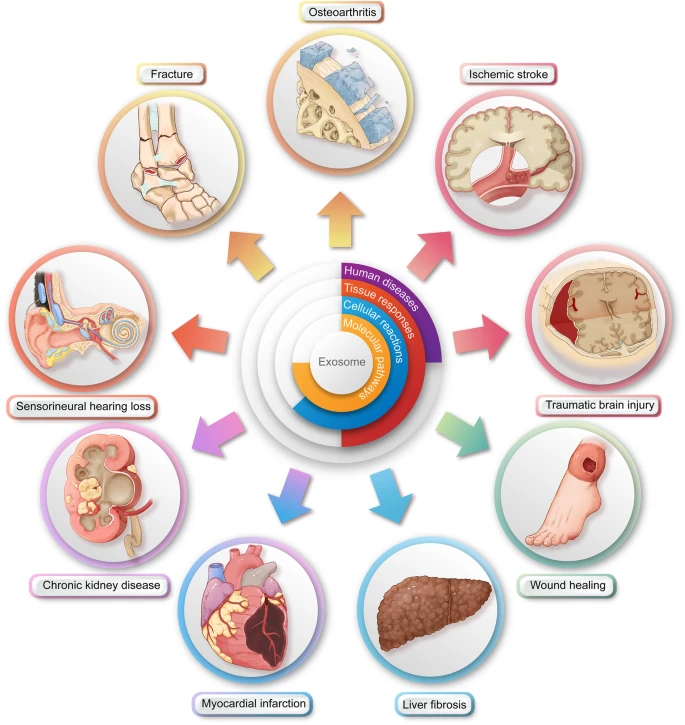
外泌体的治疗效果是通过疾病特异性组织反应、组织特异性细胞改变和细胞特异性分子信号通路分层转化而来的。
外泌体和外泌体治疗的一般背景
外泌体的生物发生、组成和摄取
外泌体在大小、含量和产生机制方面不同于其他类型的初级细胞外囊泡(例如凋亡小体和微泡)。最普遍接受的外泌体形成机制,即内体途径,如下(图1a)。初始内体是通过细胞膜内陷产生的,在此期间生物活性物质开始在早期分选内体中积累。晚期分选内体在第二次压痕后形成多泡体(MVB)。最后,MVB与细胞膜融合,将携带的外泌体释放到外部。外泌体生物发生的非内体途径,例如质膜出芽,也有报道。
正如三大外泌体数据库(即ExoCarta、Vesiclepedia和EVpedia)所总结的那样,外泌体含有众多分子,包括蛋白质、糖类、脂类、核酸、代谢物和其他生物活性物质(图1b)。一方面,外泌体由复杂的蛋白质网络组成,包括外部蛋白质(如四泛蛋白、抗原递呈复合物和粘附分子)和内部蛋白质(如热休克蛋白、ESC)、另一方面,微小核糖核酸(mRNA)是人类外泌体核酸中含量最高的物质,可通过外泌体介导的细胞通讯参与造血、外分泌以及神经和血管再生。
一旦外泌体到达受体细胞,就会有多种摄取机制,所有这些都可以分为膜融合、受体相互作用和内化(图1b)。最后,外泌体货物被释放到细胞质中,该过程取决于外泌体的来源、货物的性质以及受体细胞的代谢状态。从外泌体生物发生到摄取和细胞内信号传导的整个生命周期可以使用荧光、发光和放射性技术进行跟踪。
外泌体的来源和分类
根据外泌体是否经过人工修饰,它们大致分为天然外泌体和工程外泌体(第2.4节)。根据来源物种的不同,外泌体分为动物源性外泌体和植物源性外泌体。
目前,外泌体主要根据其亲代细胞的类型进行分类。几乎所有类型的人类细胞都可以产生外泌体。这些包括但不限于巨噬细胞、树突细胞(DC)、血小板、干细胞、甚至肿瘤细胞 (图1a)。
例如,巨噬细胞衍生的外泌体有助于疾病进展(例如糖尿病、动脉粥样硬化和心力衰竭)和疾病治疗(例如皮肤伤口、炎症性肠病以及真菌和病毒感染)。然而,它们在抑制和促进肿瘤方面似乎发挥着矛盾的作用。与DC一样,DC衍生的外泌体 (Dex) 也可以通过其表面蛋白(例如主要组织相容性复合物 (MHC))与免疫细胞(例如T细胞、B细胞和NK细胞)相互作用。一些临床前和临床试验已经证明了基于 Dex 的癌症免疫疗法的有效性和安全性。此外,肿瘤源性外泌体 (Tex) 不仅参与肿瘤增殖、侵袭、转移和免疫,还可以作为癌症诊断和治疗的生物标志物。最近,Tex已被用作抗肿瘤药物和DC疫苗接种的抗原呈递物,成为一种有前途的无细胞癌症免疫疗法。
最后,干细胞来源的外泌体的临床应用将在以下部分详细讨论。
外泌体存在于所有体液中,例如血液、唾液、尿液、血浆、眼泪、精液、羊水,甚至母乳。体液来源的外泌体是疾病生物标志物的高度稳定的储存库,有助于在癌症、心血管疾病和围产期疾病等各种临床环境中进行液体活检。然而,每种类型体液的共存内容和可用性可能会给外泌体分离带来挑战。
外泌体的生产、分离和纯化
阻碍基于外泌体的疗法进入临床实践的主要障碍之一是外泌体的产量和效率较低。例如,在实验室环境中,从1ml培养基中只能收获不到1μg的外泌体蛋白。扩大外泌体产量的方法有多种,分为生化策略(例如 LPS、BMP-2、HIF-1α、IFN-γ和TNF-α)、物理策略(缺氧、热应激和饥饿) 、机械策略(剪切应力和 3D 培养)和仪器策略(中空纤维生物反应器和搅拌槽生物反应器)。
外泌体在大小、含量、表面标记和来源方面具有异质性,这使得它们的分离变得困难。目前可用的外泌体分离和纯化技术基于其大小、表面电荷或免疫亲和力(图1a)。然而,不存在“一刀切”的方法,因为这些技术都有优点和缺点。
例如,超速离心被认为是外泌体提取的金标准。尽管它需要最少的试剂和专业知识,但耗时、成本高、效率低以及脂蛋白共分离限制了其大规模使用。免疫亲和层析是一种基于抗体和配体特异性结合的分离技术。它快速且具有高纯度、特异性和产量。然而,所使用的抗原/蛋白质偶联需要在外泌体表面表达。
基于尺寸的分离技术主要指超滤和尺寸排阻色谱,这两种技术都快速且适合大规模应用。但毛孔堵塞、外泌体丢失、纯度低等问题使得该方法难以普及。虽然没有一种技术是完美的,但将上述技术与其他技术(例如基于沉淀和基于微流体的技术)相结合可能是同时满足外泌体分离和纯化多种要求的解决方案。
外泌体的修饰
可以对外泌体进行生化修饰,以扩大、改变或改善其治疗效果。外泌体的修饰分为内部策略(例如载药)和外部策略(例如表面修饰)。一方面,外泌体由于其稳定性、非免疫原性和靶向受体细胞等优势,可能成为递送药物、核酸和疫苗的理想治疗载体。有多种货物装载技术,包括生产前装载方法(例如转染、共孵育和电穿孔)和生产后装载方法(例如冻融循环、孵育、超声处理、挤压和低渗透析),具体取决于关于它们是否在外泌体生物发生之前或之后应用(图1c)。
另一方面,外泌体表面修饰的例子有外泌体膜或亲本细胞的基因工程、靶向配体的化学连接、静电相互作用和磁性纳米颗粒技术。表面修饰的主要目的是选择性地将外泌体递送至靶细胞以进行精准治疗。
外泌体的表征和验证
外泌体在治疗应用之前需要进行表征和验证。目前用于外泌体表征的方法主要集中于外泌体的大小、形态和货物概况。面向尺寸的验证包括纳米颗粒跟踪分析 (NTA)、动态光散射 (DLS) 和可调电阻脉冲传感 (TRPS),而面向形态的分析包括扫描电子显微镜 (SEM) 和透射电子显微镜 (TEM)。此外,货物分析进一步细分为蛋白质组学、脂质组学和基因组分析,包括蛋白质印迹、ELISA、流式细胞术、质谱和PCR。由于上述每种表征方法都有优点和缺点,因此结合三个不同方面的分析(例如TEM、NTA和蛋白质印迹法)来鉴定分离的外泌体是一种普遍的做法。
例如,基于显微镜的方法,如SEM和TEM,可以分别直接可视化表面形貌和内部结构。但TEM由于操作复杂、样品制备繁琐,不适合大量样品的快速测量。NTA有助于快速检测和实时外泌体观察,同时具有比流式细胞术更高的分辨率。NTA的主要缺点是难以区分外泌体和污染的蛋白质。作为一项成熟的技术,蛋白质印迹可以定性和定量检测外泌体蛋白生物标志物的表达,特别是来自细胞培养基的外泌体。然而,该方法耗时且不适合检测生物体液中的外泌体。
外泌体的储存
目前用于长期保存外泌体的保存方法主要包括冷冻保存、冻干和喷雾干燥。温度和防冻剂是低温保存的两个最重要的因素。4℃储存可能会削弱外泌体的生物活性并减少外泌体的蛋白质含量,而-80℃被认为是最佳温度,对外泌体形态和含量的影响最小。非渗透性二糖防冻剂,尤其是海藻糖,是最佳选择,因为它可以防止外泌体聚集和冷冻损伤。
经过冷冻干燥处理的热敏材料,例如外泌体和疫苗,只需加水即可轻松储存和重构。最近的一项研究表明,即使在室温下保存,使用冷冻保护剂冻干也可以将外泌体蛋白和RNA的活性保留大约4周。
最后,与冷冻干燥相比,喷雾干燥是一个单步骤过程,从而减少了对昂贵设备和冗长的多步骤研磨的需求。然而,喷雾干燥的核心参数,如外泌体进料速率、雾化压力和出口温度,都会影响外泌体稳定性和货物完整性。
干细胞外泌体的临床应用
- 干细胞外泌体疗法与骨科和创伤手术
- 干细胞外泌体疗法与神经外科
- 干细胞外泌体疗法与整形外科
- 干细胞外泌体疗法与普通外科
- 干细胞外泌体疗法与心胸外科
- 干细胞外泌体疗法与泌尿外科和
- 干细胞外泌体疗法与耳鼻喉科和头颈外科
- 干细胞外泌体疗法与眼科
- 干细胞外泌体疗法与妇产科
外泌体疗法从临床前研究到临床试验
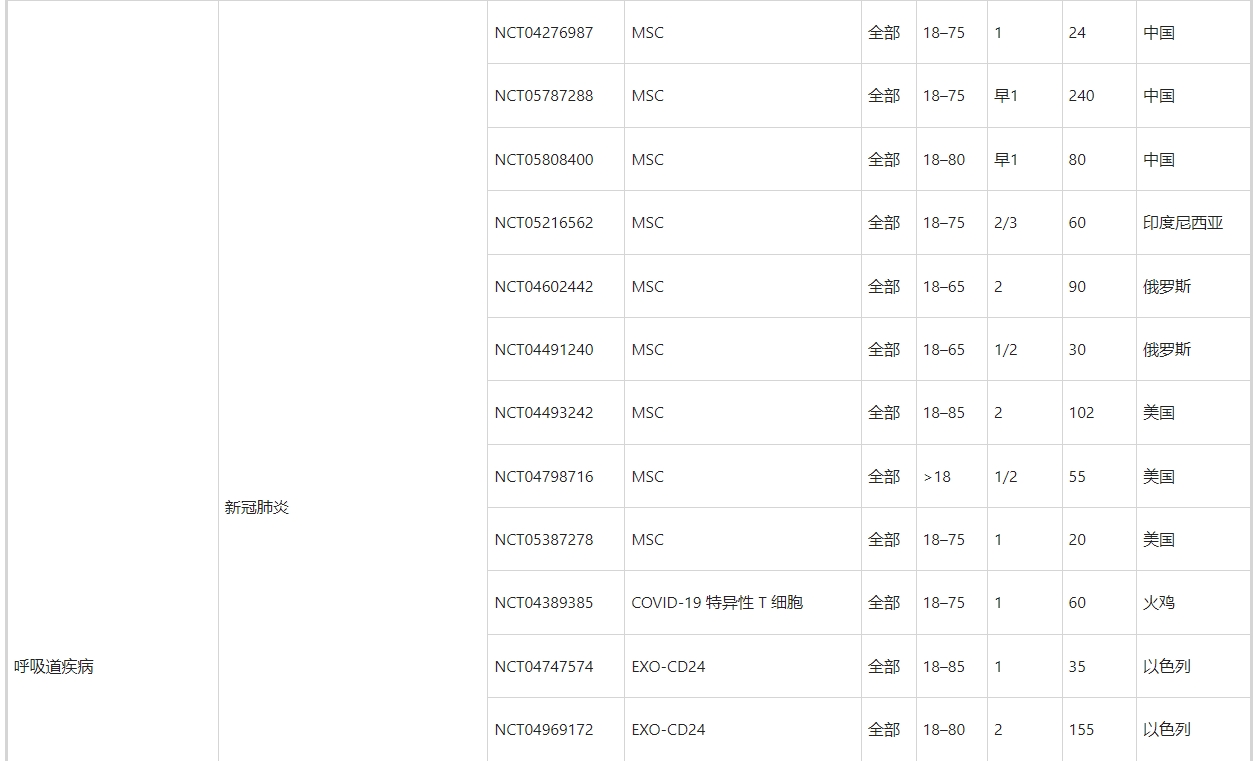
正如第3节至第11节所讨论的,许多临床前研究已经证实了MSC衍生的和NSC衍生的外泌体在治疗跨越外科实践亚专业的许多疾病方面的优势。不仅限于干细胞来源的外泌体,许多临床试验已经证明外泌体具有双重作用:生物标记物和治疗剂。在ClinicalTrials.gov上使用“外泌体治疗”、“外泌体治疗”和“外泌体”作为关键词进行搜索,生成了188条记录。然而,其中只有60项(32%)与使用外泌体作为治疗剂的介入研究直接相关(表5)。
其余的,特别是肿瘤学相关的试验,大多使用外泌体作为生物标志物,例如疾病发病过程中的关键角色(例如NCT04288141,NCT04154332),诊断标志物和治疗前的指导(例如NCT04629079,NCT03791073,NCT05451342,NCT03432806),监测指标治疗效率的预测工具(例如,NCT05427227、NCT04499794、NCT04852653、NCT05370105、NCT03800121、NCT05370105、NCT05328089)和治疗后的预后指标(例如,NCT06026735、NCT05705583、NCT05) 411445、NCT04167722、NCT05575622)。外泌体作为生物标志物的临床应用已在其他综述中进行了广泛探讨,因此在本综述中不予讨论。就60项外泌体治疗临床试验的临床特征而言(表5),有几个亮点值得一提。
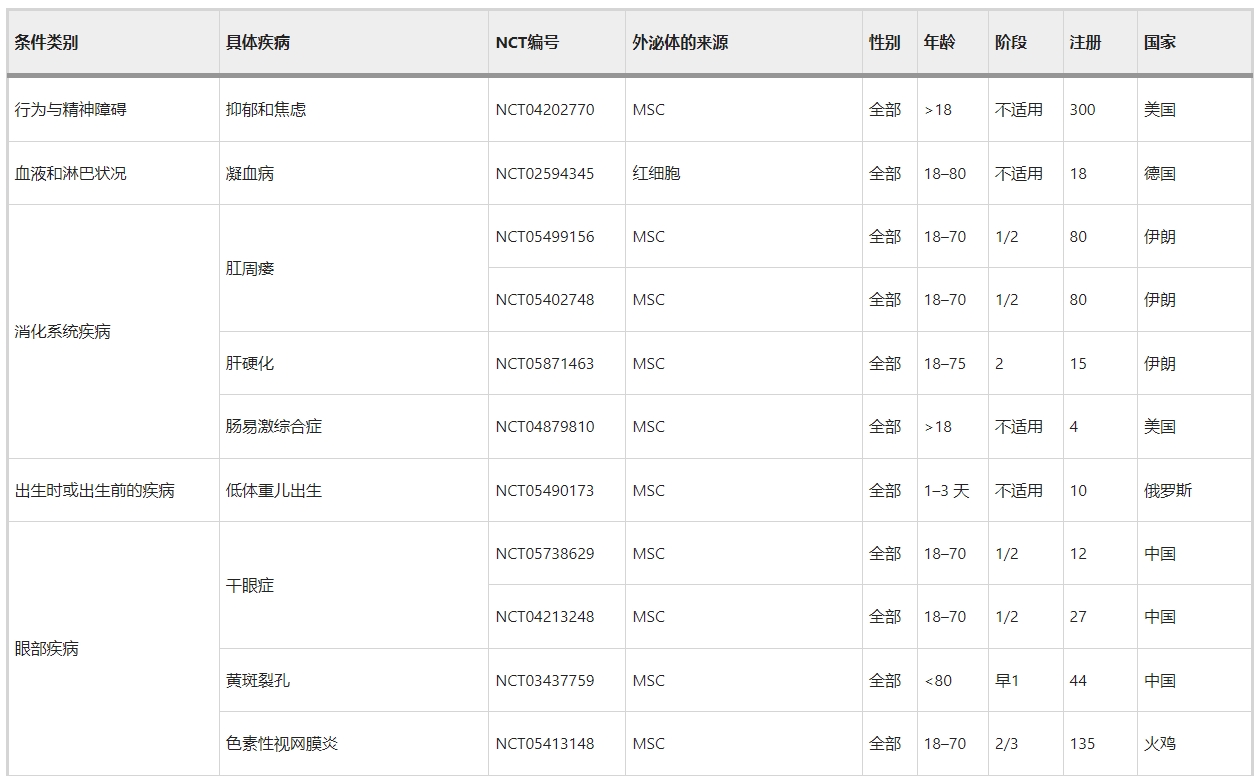
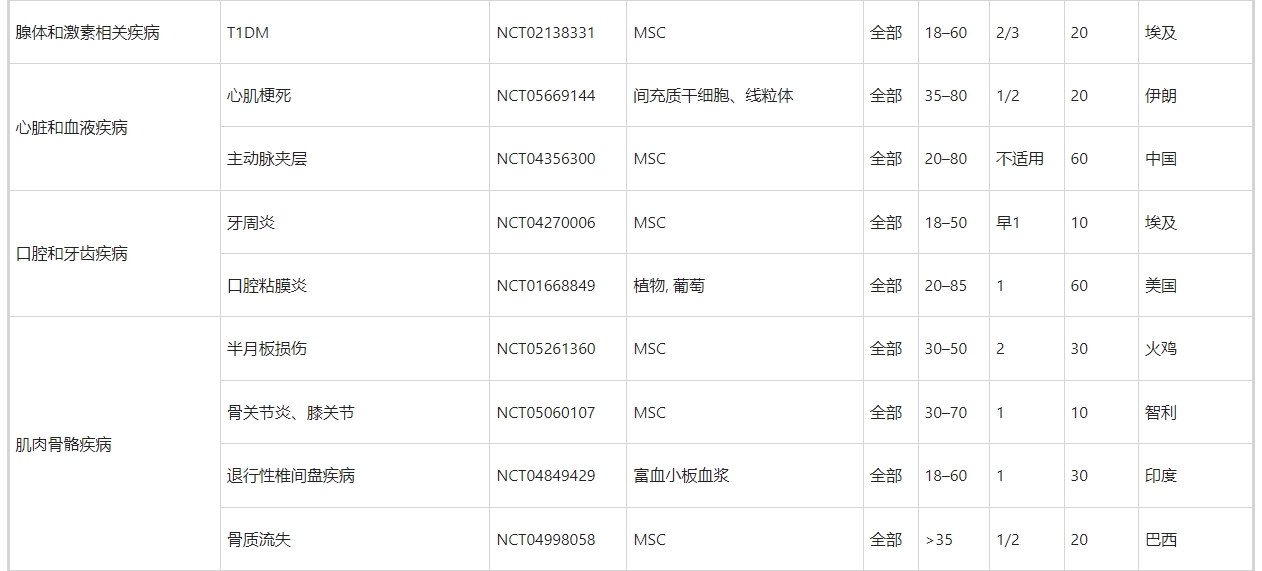
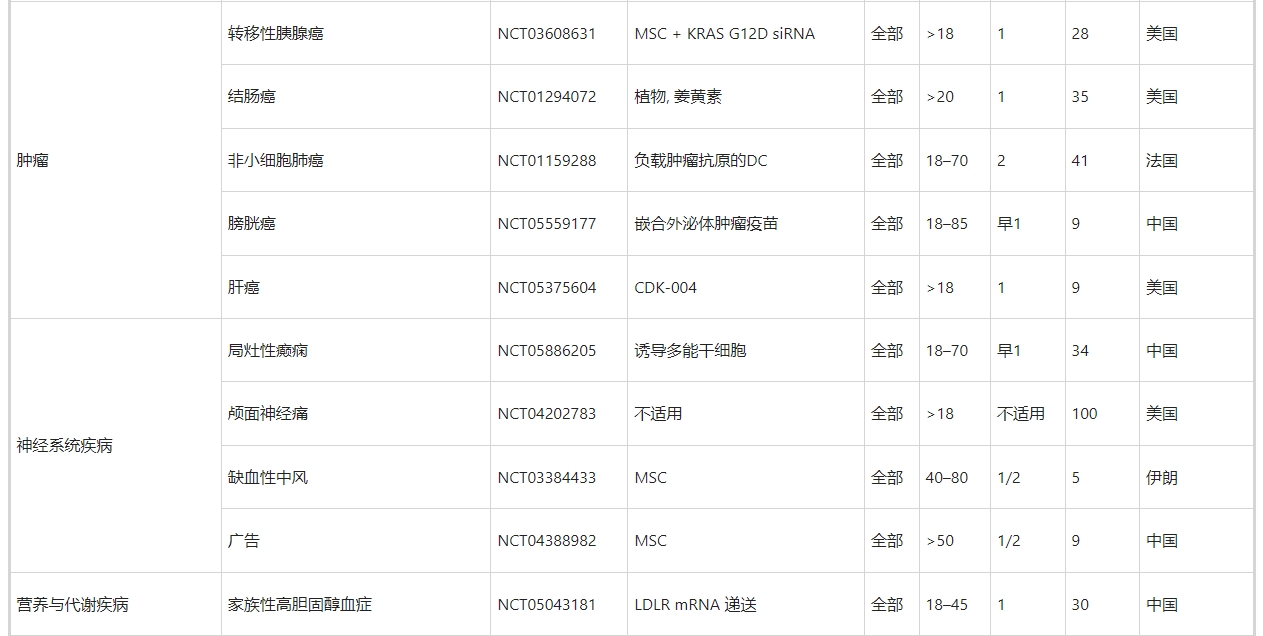
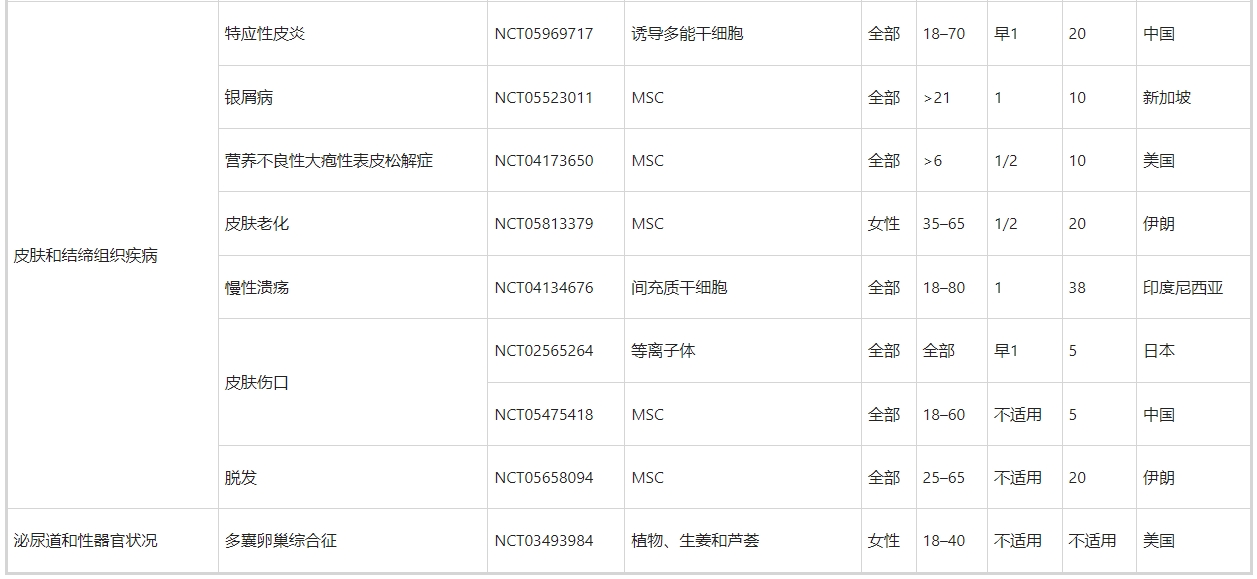
首先,所涵盖的疾病范围非常广泛,包括外科疾病和内科疾病。其中包括第3至11节中讨论的许多外科疾病,例如骨科疾病(NCT05060107中的膝骨关节炎、NCT04998058中的骨质流失和NCT04849429中的椎间盘退变)、神经外科疾病(NCT03384433中的缺血性中风和NCT04388982中的阿尔茨海默病) 、整形外科疾病(NCT02565264和NCT05475418中的皮肤伤口愈合)、普通外科疾病(NCT05871463中的肝硬化)、心胸疾病(NCT05669144中的心肌梗塞)、眼科疾病(NCT05413148中的视网膜色素变性)。
也就是说,一些临床前研究还没有发展到临床试验。这些包括但不限于用于骨折、脊髓损伤、创伤性脑损伤、急性肝损伤、和听力损失的外泌体疗法,这可能作为外泌体疗法相关临床试验的未来方向。
其次,越来越多的临床试验集中在两种疾病上,即COVID-19(16项试验,占27%)和癌症(5项试验,8%)。MSC 衍生的外泌体可以通过修复作用和再生作用来控制COVID-19中的病毒感染和肺损伤。前者表现为阻断病毒进入和复制以及抑制细胞因子风暴,而后者则表现为预防炎症、清除液体和恢复肺通透性。此外,外泌体可以被设计成药物(例如,CD24,一种有效的免疫调节剂)递送平台,甚至疫苗来对抗COVID-19。与用于COVID-19管理的MSC衍生的外泌体相比,用于癌症治疗的外泌体主要依赖于非干细胞和货物工程。这部分是因为间充质干细胞衍生的外泌体对肿瘤发生和转移的影响存在争议。虽然MSC衍生的外泌体与肿瘤细胞之间的确切相互作用仍有争议,但科学家们通过修饰外泌体货物以递送抗癌核酸和抗癌药物,以及用于特定肿瘤靶向的外泌体膜,克服了一些障碍。
最后,在使用干细胞来源的外泌体进行疾病治疗的40项临床试验中,38项(95%)使用MSC,2项(5%)使用iPSC作为外泌体的细胞来源。然而,这与第3节至第11节中讨论的临床前研究存在显着差异。在临床试验中缺乏使用 NSC 衍生的外泌体可能部分是因为其亲代细胞的供应限制。
目前,神经干细胞可以从三个来源获得(图1a):
- 1、从原代CNS组织(例如成人和胎儿大脑)中分离;
- 2、从多能干细胞(例如iPSC和ESC)分化;
- 3、将体细胞(例如成纤维细胞和血细胞)重编程为iNSC。最近的研究开发了成纤维细胞衍生的iNSC,为从NSC样细胞获取外泌体打开了新窗口。
这些iNSC-exo不仅可以在体外促进细胞存活和增殖,其效果不亚于NSC-exo,而且还可以增强缺血性中风后的恢复并减轻临床前模型中的AD样表型。因此,iNSC可能是在临床试验中生产临床级外泌体的极好细胞来源。
总之,外泌体疗法从临床前研究到临床试验的进展非常迅速。然而,外泌体治疗的临床适应证不足和亲本干细胞来源有限等问题仍有待解决。此外,一旦克服了生产规模扩大、遵守良好生产规范和监管框架方面的限制(表1), 干细胞衍生的外泌体疗法将很快纳入临床实践并在患者床边服务。
结论和未来展望
最近,外泌体被视为干细胞疗法的无细胞替代品。ESC、iPSC、HSC、MSC、NSC 和 EPC 衍生的外泌体特别令人感兴趣,部分原因是其亲本细胞的多能性。经过修饰或不修饰的生产和纯化后,干细胞来源的外泌体在治疗外科手术中遇到的多种疾病方面表现出了巨大的潜力。
例如骨科手术中的疾病(例如骨折、骨关节炎和脊髓损伤);神经外科(例如,缺血性中风、创伤性脑损伤和阿尔茨海默病);整形手术(例如伤口愈合);普通外科手术(例如急性肝损伤);心胸外科手术(例如心肌梗塞);泌尿科(例如慢性肾病);头颈手术(例如感音神经性听力损失);眼科(例如,获得性视神经病变)和妇科(例如,原发性卵巢功能不全)。
从机制上讲,干细胞来源的外泌体的多种治疗作用是通过疾病特异性细胞和组织反应(例如组织再生、抗炎、抗细胞死亡、免疫调节和抗氧化应激)和组织特异性分子来实现的。信号通路(例如 Wnt/β-连环蛋白、PTEN/PI3K/Akt/HIF-1α、MAPK 和 JAK/STAT 通路)。总的来说,干细胞衍生的外泌体疗法已被证明是外科领域干细胞疗法的有效且多功能的替代品。
参考资料:Tan, F., Li, X., Wang, Z. et al. Clinical applications of stem cell-derived exosomes. Sig Transduct Target Ther 9, 17 (2024). https://doi.org/10.1038/s41392-023-01704-0
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号