概述:过去十年,转化干细胞研究领域取得了巨大进步。分化方案的开发和完善,使我们能够以高效和符合良好生产规范的方式,从人类多能干细胞(hPSC)中生成一系列细胞类型,如胰腺β细胞和多巴胺能神经元。因此,利用hPSC衍生细胞替代丢失或功能障碍细胞的几项临床试验已经启动,证明了其安全性和有效性。在此,我们将重点介绍一些基于hPSC的成功试验,这些试验报告了早期疗效迹象,并讨论了细胞疗法临床转化过程中常见的挑战。
介绍
1998年首次衍生出人类胚胎干细胞 (hESC) ,随后于2007年通过体细胞重编程突破性地产生了人类诱导多能细胞 (hiPSC) 。人们期望基于人类多能干细胞(hPSC)的新型再生疗法可以彻底改变慢性病的治疗。hPSC的特点是无限的自我更新能力和分化潜力,因此代表了细胞替代疗法的理想来源,用于治疗特定细胞类型功能失调或丢失的疾病。然而,hPSC技术经过大约二十年的技术发展才成熟到产品开始进入多种疾病和大量临床试验的阶段。
现在,该领域已达到短期安全性临床报告以及早期疗效证据开始出现的阶段(表1)。在即将进行的III期研究中对此类结果的前瞻性证实(参见词汇表,专栏1)确实可能标志着再生医学新时代的开始。在本次聚焦中,我们讨论了与基于hPSC的细胞疗法的临床转化相关的挑战,并强调了临床试验中有希望的进展。
- 年龄相关性黄斑变性(AMD):一种以中心视力丧失为特征的疾病。它是由视网膜中央部分(黄斑)细胞的进行性功能障碍和变性引起的。干性形式的特点是黄斑内有玻璃膜疣沉积,而湿性形式则涉及通过从下面的脉络膜穿透渗漏血管来破坏RPE层(图2)。
- 先进治疗药品(ATMP):一种基于基因、细胞或组织疗法的药物。
- 临床试验:研究旨在评估研究药物对人类受试者的影响。它们分为三个阶段:I、II和III。I期临床试验是对药品进行首次人体测试以评估安全性。对于细胞疗法,这通常与I/IIa期试验中的早期疗效评估和剂量探索相结合。II期临床试验在大量人类受试者中评估安全性和有效性终点。III期临床试验证实了临床疗效。
- 地理萎缩:干性AMD的一种晚期形式,其特征是视网膜萎缩性病变。
- 良好实验室规范 (GLP):一套关于计划、执行、监测、记录、报告和存档非临床安全性研究的组织流程和条件的规则和标准。
- 良好生产规范 (GMP):药品制造商在其生产过程中必须满足的最低标准。
- 内侧颞叶癫痫(MTLE):成人癫痫的一种常见形式,其特征是局灶性癫痫发作,通常由于兴奋性和抑制性神经元活动不平衡而在海马体中出现。
- 作用方式(MoA):细胞治疗产品发挥作用的过程。
- 帕金森病(PD):一种神经退行性疾病,其特征是黑质中的多巴胺能神经元选择性丧失,导致震颤和运动迟缓等运动症状。
- 概念证明(PoC):证明细胞疗法在某种疾病情况下是可行且有效的。临床前PoC通常在动物模型中产生,而临床PoC则通过I期和II期临床试验在人类受试者中建立。
- 斯塔加特黄斑营养不良症:由ABCA4基因序列变异引起的遗传性眼病。它是最常见的儿科黄斑变性。
- 血小板减少症:一种以血液中血小板数量异常低为特征的疾病,会导致出血并发症。
- 1型糖尿病 (T1D):一种自身免疫性疾病,胰岛β细胞丢失,导致胰岛素缺乏和高血糖。
图1:将细胞疗法应用于临床的步骤。
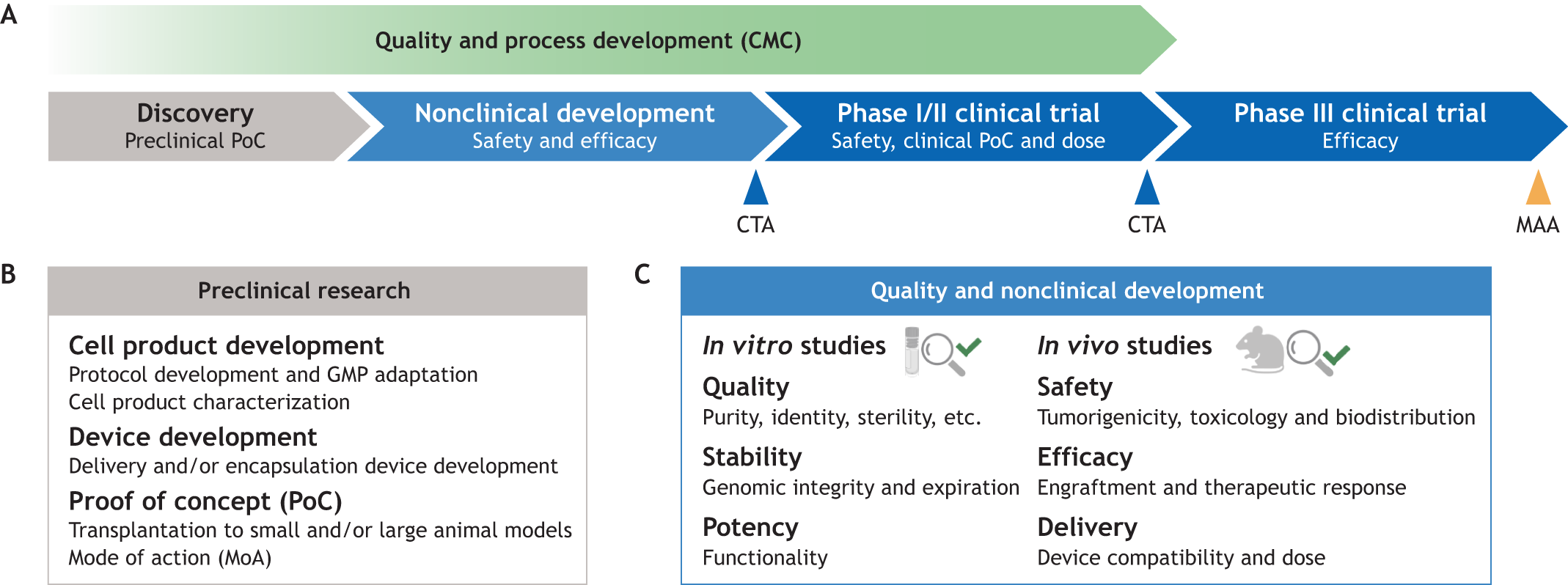
- (A) 从研究到上市的各阶段示意图。在发现阶段进行临床前概念验证(PoC)之后,细胞产品要在动物模型中进行非临床研究,以证明其安全性和有效性,从而为临床试验授权(CTA)申请提供支持。与此同时,还要进行质量和工艺开发,即化学、制造和控制(CMC),包括原材料鉴定、分析测试开发和规格制定。获得监管部门批准后,细胞产品将在一小部分患者中进行测试,通常是在I/II期联合试验中进行,以评估安全性、剂量并提供早期疗效评估(临床PoC)。在申请市场准入许可(MAA)之前,临床疗效将在II期和III期试验中得到进一步评估。
- (B)临床前阶段的主要步骤。这些步骤包括细胞产品和任何必要设备的开发和表征,以及移植到小型(也可能是大型)动物模型上。GMP,良好生产规范。
- (C) 非临床研究中需要评估的关键参数。这些参数包括细胞产品的质量、安全性和有效性。
图2:使用hPSC衍生细胞产品进行开创性临床试验时所涉及的细胞类型和注射部位的图示。
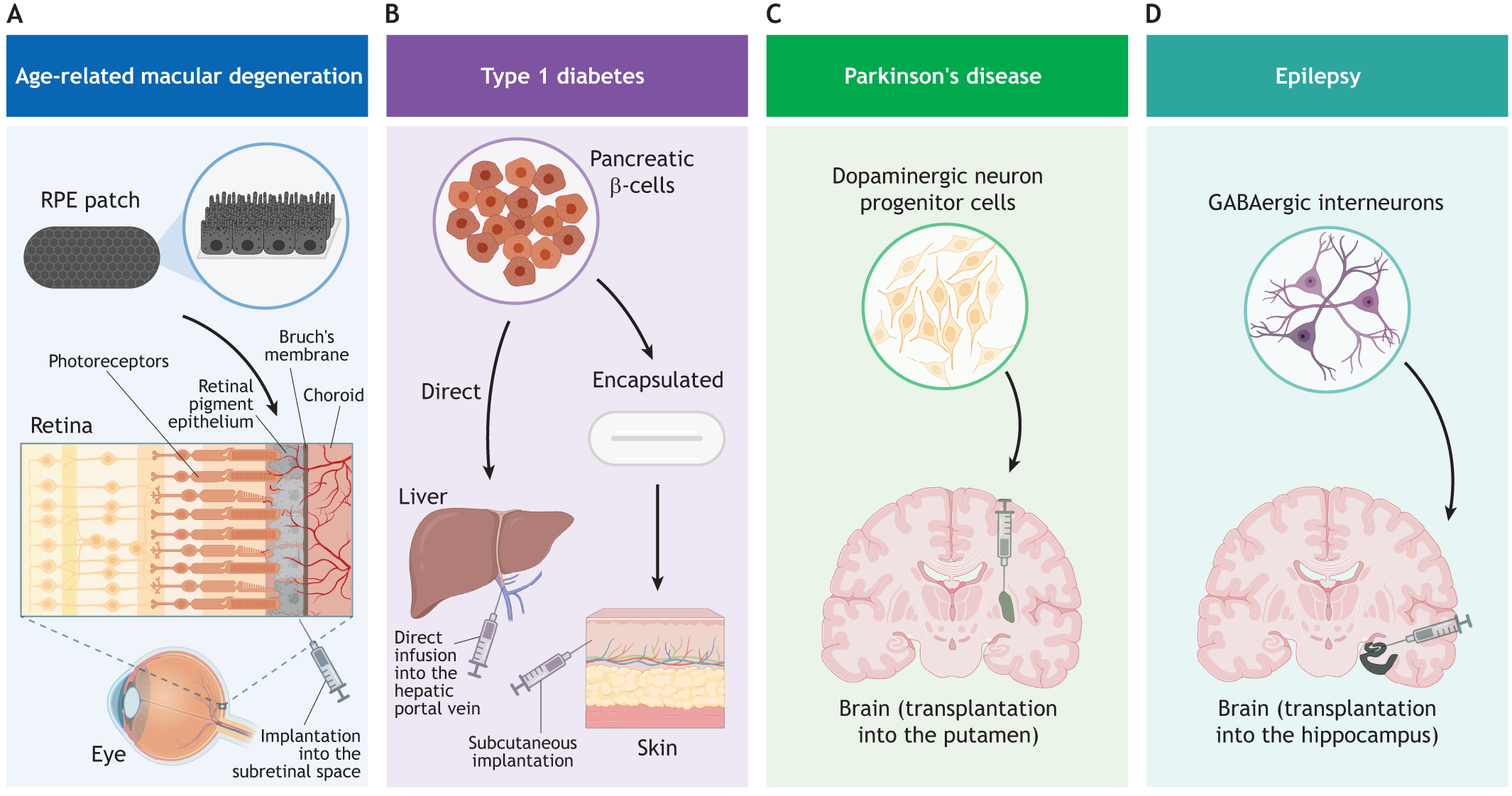
- (A) 将合成膜上的一片视网膜色素上皮 (RPE) 植入视网膜下腔,用于治疗湿性年龄相关性黄斑变性 (AMD)。插图显示视网膜细胞层,包括光感受器、RPE、布鲁赫膜和脉络膜。已经启动了多项临床试验来评估AMD的细胞治疗产品,但本文并未涵盖所有试验。使用RPE贴片方法的I/II期临床试验的例子有NCT01691261(英国)和NCT02590692(美国)。其他试验涉及悬浮液中的RPE样细胞的递送,例如NCT01344993(美国)。
- (B) 用于治疗1型糖尿病的胰腺β细胞通过直接输注至肝门静脉或皮下植入封装装置内来施用。评估这些治疗策略的I/II期试验包括NCT02239354、NCT04678557、NCT03163511、NCT04786262和NCT05791201(美国/加拿大)。
- (C) 将多巴胺能神经元祖细胞注射到壳核中以治疗帕金森病。多个团队正在进行I/II期试验的临床评估:UMIN000033564(日本)、NCT04802733(美国/加拿大)、NCT05635409(瑞典/英国)和NCT05887466(韩国)。
- (D) 将抑制性GABA能中间神经元移植到海马区,用于治疗内侧颞叶癫痫。I/II期试验NCT05135091(美国)正在进行临床评估。
临床试验有望取得进展
针对年龄相关性黄斑变性患者的临床试验首次显示出临床疗效
Geron试验之后,基于hPSC的疗法首先针对的疾病之一是年龄相关性黄斑变性(AMD)——一种导致失明的主要原因。AMD的特征是由于底层视网膜色素上皮(RPE)损伤而导致视网膜中感光细胞进行性退化(图2A)。将从患者周边视网膜分离的自体RPE斑块移植到退化黄斑区域的努力提供了RPE替代的概念证明。
随后,研究小组开始寻求基于hPSC的RPE替代,目前正在进行多项临床试验。
Advanced Cell Technology(后来称为安斯泰来再生医学研究所)进行的两项平行临床试验(NCT01344993和NCT01345006)显示了hESC衍生的RPE移植的初步安全性。细胞产物是通过胚体自发分化产生的,然后手动分离RPE细胞,随后将其作为细胞悬浮液注射到视网膜下腔中。这些相对简单的制造和交付程序允许早期进入临床。
该临床研究于2011年启动,涉及伴有地理萎缩的终末期干性AMD个体和患有斯塔加特黄斑营养不良症的个体,后者是儿童黄斑变性的最常见原因。移植的细胞耐受性良好,没有与移植物相关的严重副作用,并且在大多数患者中观察到治疗区域的视网膜下色素沉着增加,表明RPE细胞存活。在移植后的第一年,少数接受治疗的眼睛的视力略有改善;然而,缺乏实质性的功能改进。
伦敦治愈失明项目于2013年将一种更先进的基于hPSC的RPE细胞疗法引入临床测试。由Pete Coffey领导的团队开发了一种贴片,该贴片由生物相容性合成膜上的hESC衍生的RPE单层组成(图2A)。与悬浮的RPE细胞不同,该贴片可以输送完全分化和极化的上皮层,增加功能整合到视网膜的机会。
此外,该团队还开发了一种专用手术设备,可以提供覆盖几乎整个黄斑的完整补片。在小鼠和猪中完成非临床研究后,该产品在一组被诊断患有湿性AMD的人群中进行了测试 (NCT01691261)。前两名受试者的早期临床数据显示,移植后1年,整个斑块上存在存活的RPE细胞。引人注目的是,两名受试者的视力在早期治疗糖尿病视网膜病变研究 (ETDRS) 字母表中显着提高了29个和21个字母,阅读速度分别从1.7字/分钟提高到82.8字和从0字/分钟提高到47.8字/分钟。因此,这是第一个证明基于hPSC的疗法在人类中具有令人信服功效的试验。
Rogenic Patch Technologies ( NCT02590692 )进行的I/II期试验中使用了类似的贴片方法,涉及将hESC衍生的RPE移植到合成膜上,这次针对患有晚期干性AMD的个体伴有地理萎缩。前五名受试者的早期结果显示,四名受试者成功植入贴片,证明了可行性和短期安全性。在接受治疗的个体中,其中一名受试者的视力提高了17个ETDRS字母,而其余受试者则没有显着改善。移植物存活和安全性在2年随访中得到证实。
这些研究共同证明hPSC衍生的RPE细胞疗法确实可行且安全。此外,早期但令人信服的证据表明,RPE贴片移植对湿性AMD患者有效,强调了这种治疗恢复视力的独特潜力。因此,这些开创性的研究阐明了未来试验中有关细胞产品、支架和递送方法的设计以及合适的目标患者群体的选择的重要考虑因素。
接受β细胞移植的1型糖尿病患者的早期疗效报告
基于hPSC的细胞疗法开发的另一个有前景的领域是治疗1型糖尿病(T1D),这是一种慢性自身免疫性疾病,其中分泌胰岛素和调节血糖的胰腺β细胞被破坏。尸体供体胰岛组织的移植已经进行了数十年,证明同种异体胰岛移植是有效的。多个研究团队致力于开发指导胰腺祖细胞与hPSC分化的方案。该领域的一个挑战是在体外产生成熟且有功能的β细胞。
2014年,Viacyte启动了一项首次人体临床试验(NCT02239354),其中将hESC衍生的胰腺祖细胞装入细胞不可渗透的免疫保护装置中,并皮下输送给T1D患者,无需免疫抑制。据报道,该治疗安全且耐受性良好,没有同种免疫或自身免疫反应的迹象;然而,由于移植和细胞存活率较差,可能是由于血液供应不足,该试验被暂停。
更有希望的是Vertex Pharmaceuticals于2021年启动的一项完全分化胰岛细胞产品 ( NCT04786262 )正在进行的试验的报告结果。
在该试验中,细胞通过直接输注至门静脉进行肝内递送,因此需要长期施用免疫抑制剂。新闻稿中报道了前六名接受治疗的受试者的积极结果;所有受试者均表现出内源性胰岛素产生,C肽水平在正常范围内,前两名受试者已完全独立于胰岛素药物治疗。尽管临床数据尚未公布,但报告的疗效非常令人鼓舞。
此外,Vertex Pharmaceuticals于2022年收购Viacyte后,该公司宣布启动临床试验 ( NCT05791201 ),测试在新型免疫保护封装装置内输送完全分化的胰岛细胞的可行性。
多巴胺能神经元替代为帕金森病患者带来希望
帕金森病是细胞替代疗法的理想靶点,因为单个细胞类型(A9多巴胺能神经元)的选择性缺失会导致运动功能受损。事实上,使用胎儿间脑组织进行细胞替代已经尝试了三十多年,这些开创性的努力提供了证据,证明多巴胺能神经元可以成功移植并在大脑中长期存活,同时为某些个体提供显著的症状恢复。然而,胎儿组织的异质性和供应不足限制了这种方法的临床实用性。
为此,几个研究小组同时开发了从hPSCs定向分化可移植多巴胺能祖细胞的方案。啮齿类动物的移植研究表明,hPSC衍生的多巴胺能祖细胞在功能上等同于从胎儿间脑组织获得的多巴胺能祖细胞,光遗传学/化学遗传学移植沉默实验证实,行为恢复是由神经元活动依赖性多巴胺释放诱导的。
在过去十年中,这些分化方案得到了进一步改进,以提高纯度和符合GMP要求,临床前研究证实了啮齿动物、非人灵长类动物和猪的疗效和移植成熟度,为这些产品的临床评估铺平了道路。此外,移植细胞具有通过多巴胺转运体缓冲外源性多巴胺的能力,这表明多巴胺神经元功能已经成熟。然而,移植的祖细胞也会产生其他神经元和非神经元细胞类型。同样,提高移植细胞存活率和增加多巴胺能神经元数量的改进措施将减少所需的移植体积,甚至可能加快功能恢复。
迄今为止,三项I/II期临床试验已经开始,全部基于多巴胺能祖细胞的壳内移植(图2C)。
由Jun Takahashi领导的第一项试验于2018年在日本启动(UMIN000033564)。虽然支持该试验的临床前数据已经发布,但该临床试验的主要2年终点预计在2023年底之前完成。
第二项试验由BlueRock Therapeutics赞助,评估了Lorenz Studer和Viviane Tabar在晚期PD个体中开发的hESC衍生细胞产品( NCT04802733 )。第一个受试者于2021年接受给药,12名受试者的1年安全性结果在2023年8月的运动障碍协会年会上发布,报告称该疗法耐受性良好,并且通过18F-DOPA观察到移植物存活的迹象PET成像。
第三项正在进行的试验STEM-PD ( NCT05635409 ) 由隆德大学和剑桥大学的团队发起,于2023年初开始给药,以评估中度PD个体的多巴胺能祖细胞移植情况。该试验的主要目标是证明细胞产品在12个月时的安全性、可行性和耐受性,次要目标包括评估24个月和36个月时的临床疗效。除了这些正在进行的试验之外,韩国的一个团队最近获准在PD患者中启动细胞疗法的临床测试 (NCT05887466),该疗法的临床前数据刚刚发布。
中间神经元细胞疗法可减轻癫痫患者的癫痫发作
2023年另一个令人兴奋的进展是Neurona Therapeutics开发的一种新型抑制性中间神经元疗法用于治疗内侧颞叶癫痫的1年临床结果的公布。这是一种局灶性癫痫,其中癫痫发作是由大脑受限区域的异常神经元过度活跃引起的,从而构成了抑制性中间神经元传递以抑制癫痫发作活动的潜在合适目标。通过移植啮齿动物内侧神经节隆起(MGE)组织,初步证明癫痫实验模型中癫痫发作活动减少。
后来,开发了从hPSC生成这些MGE细胞的分化方案,并且通过证明宿主大脑中移植的中间神经元的突触整合和啮齿类动物的移植研究建立了PoC和MoA。抑制性神经递质GABA的活动依赖性释放。
临床前PoC支持一项首次人体临床试验 ( NCT05135091 ),该试验涉及将hESC衍生的抑制性中间神经元单次注射到耐药MTLE个体的海马区(图2D)。在一份新闻稿中,该公司宣布了第一批受试者的显着结果。据报道,所有5名受试者的治疗耐受性良好,此外,接受治疗的前两名受试者的癫痫发作活动减少了95%以上。值得注意的是,一名在移植前每月癫痫发作超过30次的受试者在治疗7个月后报告癫痫发作消失。
多能干细胞疗法临床转化的挑战
将基于hPSC的细胞疗法推向临床面临着三个主要挑战。
- 首先,将分化方案推进到可以从高纯度hPSC中产生真实且有功能的细胞类型而不产生危险的脱靶细胞的阶段,需要进行多年的研究和测试涉及组织特异性细胞类型规范的因素。
- 其次,在许多情况下,细胞的体内测试需要开发新颖且具有挑战性的动物模型,将有效的免疫抑制与遗传或病变诱发的疾病表型相结合,以及细胞移植的专门方法以获得长期异种移植,在某些情况下需要开发专用设备来提供细胞产品。
- 第三,使所有原材料和生产程序适应良好生产规范以及在良好实验室规范下对动物进行长期安全性研究的要求(图1)进入临床较晚。这种新型疗法的不确定监管途径使情况变得更加复杂。值得注意的是,在欧盟内部,生产设施花了数年时间才实施2007年立法,该立法提高了对先进治疗药品的监管要求。由于细胞疗法复杂的制造程序、严格的监管审批流程和高昂的成本,许多学术团队已与制药或生物技术公司合作进行临床试验。
在接下来的文本中,我们讨论这些努力并考虑它们对基于多能干细胞的疗法的未来的影响。
结论和观点
在过去的十年中,人们在从高纯度hPSC中生产特殊细胞类型并在相关动物模型中建立PoC方面付出了巨大的努力,最终使该领域达到了可以在人类受试者中评估这些细胞用于治疗各种疾病的阶段。
I/II期临床试验已证明基于hPSC的细胞疗法的安全性和可行性,并且在AMD、T1D和MTLE个体中报告了令人鼓舞的疗效证据。这些开创性的研究提供了重要的经验教训,可以指导未来的试验,以增加成功的机会。
长期免疫抑制治疗的要求是同种异体细胞疗法临床转化的常见障碍,低免疫细胞系的基因工程为此提供了一条有希望的道路。下一代细胞疗法的其他挑战和策略围绕着进一步完善分化方案以提高成熟度和纯度,以及改善移植物存活和功能整合;后者可以通过细胞和基因联合治疗或多种细胞类型的共同递送来实现,以实现复杂组织的重建或增强血管化。
基因编辑技术的不断进步也有望推动功能增强的细胞治疗产品的进一步开发。这些早期的成功和正在进行的临床开发为再生医学的未来带来了希望,并为未来几年更多细胞疗法进入临床奠定了基础。
参考资料:Josefine Rågård Christiansen, Agnete Kirkeby; Clinical translation of pluripotent stem cell-based therapies: successes and challenges. Development 1 April 2024; 151 (7): dev202067. doi: https://doi.org/10.1242/dev.202067
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号