近年来,美国伊利诺伊大学芝加哥分校在《springer Link》上发表一篇关于人类间充质干细胞疗法治疗卵巢早衰的新方法,报道中显示间充质干细胞疗法可作为用于激活卵巢皮质中剩余的原始卵泡以恢复生殖潜力的新方法。

卵巢早衰 (POI) 是一种以40岁之前卵巢功能丧失为特征的疾病。临床表现为高促性腺激素性性腺机能减退状态,诱发原发性或继发性闭经、不孕和雌激素缺乏的迹象。
POI的发病率因年龄而异,到35岁时,每250名女性中就有1名发病,到40岁时,每100名女性中就有1名发病。诊断依据是促卵泡激素水平升高(>25IU/L)两次,间隔1个月,同时雌二醇水平降低(<50pg/mL)和40 岁以下女性闭经至少4个月。当诊断POI以排除潜在病因时,评估是必要的。很多时候,POI是医源性的,由手术、化学疗法或放射疗法引起。自发性POI的其他病因包括 Turner综合征或Turner马赛克变体、脆性X综合征和自身免疫性疾病。在许多情况下,病因仍然未知。
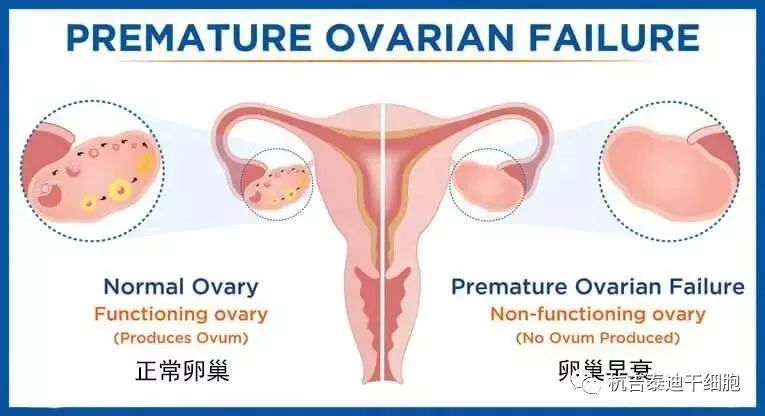
无论是在POI的情况下,还是在自发绝经的情况下,卵巢皮质中仍然存在少量原始卵泡。由于不发达国家和发达国家的生育延迟,许多妇女在未完成生育的情况下发生POI或进入更年期。对于这些女性来说,如果她们没有在生命早期储存卵母细胞或胚胎,建立家庭的唯一选择是使用捐赠的卵母细胞或收养,这会带来巨大的成本、心理影响和道德挑战。
此外,在某些宗教团体或社会中,他们可能会被劝阻甚至禁止。对于患有POI的女性,广泛的研究集中在如何招募她们剩余的卵泡、激活它们并发挥她们的生殖潜力。这篇综述描述了目前为实现这一目标而采取的各种干细胞治疗方法。
干细胞疗法治疗卵巢早衰
干细胞是独特的多能细胞,具有在适当条件下分化成任何细胞类型的能力。研究人员研究了它们作为新卵泡单位前体的潜在用途,或者它们是否可用于激活卵巢皮质中剩余的原始卵泡以恢复生殖潜力(表1和表2)。


羊膜干细胞
羊膜是覆盖发育中的胚胎并将其保持在羊水中的膜。它被认为是一种废物,通常在交货后被丢弃;然而,人类羊膜干细胞 (hAMSC) 可以从该膜中分离出来。
hAMSC已被证明具有自动再生能力,具有多种分化能力,并提供与其他多能间充质干细胞 (MSC) 相似的抗炎作用。hAMSC分泌人生长因子、胰岛素样生长因子-1(IGF-1)、血管内皮生长因子(VEGF)、生长分化因子-9(GDF-9)、白血病抑制因子(LIF)和其他干细胞因子,大多数具有组织愈合特性。
刘等人证明在POI诱导的小鼠中移植hAMSC会降低炎性细胞因子,表明组织损伤的解决。这些小鼠还表现出雌激素增加和FSH 减少,证实卵巢功能恢复导致成功怀孕。
脐带干细胞
脐带是MSC的另一个丰富来源;脐带间充质干细胞 (UCMSC) 是多能、非造血祖细胞,可分化成多种细胞系。
穆罕默德等人表明将UCMSC给药到化疗诱导的POI小鼠的卵巢中可恢复卵巢功能和生育潜力。治疗后,FSH水平显著下降,血清AMH升高水平,恢复排卵和怀孕,然后分娩幼崽。因此,在POI 小鼠中用UCMSC治疗解决了卵巢的内分泌和外分泌功能。
杨等人证明UCMSC的生殖效应可能是由于卵巢血管生成增加,促进颗粒细胞增殖和卵泡生长发育。
胎盘源干细胞
与其他类型的干细胞相比,人胎盘来源的间充质干细胞 (hPMSC) 很容易获得。这些多能和非造血祖细胞具有高分化和增殖潜力。
尹等人证明通过调节T细胞静脉内应用hPMSC在自身免疫介导的POI小鼠中恢复卵巢功能。他们观察到细胞因子的产生增加,例如转化生长因子β(TGF-β),它抑制炎症并有助于卵巢功能的恢复。他们还注意到干扰素γ (IFN-γ) 的同时减少,干扰素抑制排卵并促进卵泡闭锁。hPMSC治疗两周后,发情周期数增加,雌激素产生增加,同时FSH减少,从而证实卵巢内分泌功能恢复。此外,他们描述了hPMSC移植后小鼠的血流量增加和颗粒细胞凋亡减少。
人类经血干细胞
月经源性干细胞 (MenSC) 显示出与其他间充质干细胞相似的多能性和高度增殖性特征。MenSC表达MSC标记并在体外生长并粘附在培养表面上。
王等人。证明静脉注射MenSC可以通过刺激细胞增殖来修复卵巢损伤并改善卵巢功能。
脂肪干细胞
脂肪来源的干细胞 (ASC) 很容易大量收获。它们可以从手臂、大腿或腹部的皮下脂肪组织中获得,因为这些区域往往有更多的脂肪细胞。
马沙耶基等人对9名女性进行腹部组织脂肪干细胞分离,分离 ASC后,经阴道注射细胞;然而,由于技术困难,他们对2名患者进行了腹腔镜移植。共有4名患者表现出月经周期恢复,4名患者FSH水平下降。这种方法似乎是一种可行、安全和创新的POI治疗方法,尽管文献中报道的研究很少。需要更多的基础和人体研究来更好地了解ASC治疗POI的临床适用性。
骨髓干细胞
骨髓干细胞(BMSC)是一种免疫原性低的成体干细胞。与其他干细胞相似,它们具有增殖和多能潜能,并且在适当的条件下,它们分化成骨、软骨和脂肪细胞。此外,BMSC易于在体外分离和生长。它们在增强内源性细胞功能和调节免疫反应方面的作用使它们成为修复组织损伤的理想药物。
古普塔等人发表了一篇病例报告,其中一名围绝经期妇女在 BMSC移植后8周成功怀孕。
在一项针对30名POI女性的研究中,Gabr等人给予粒细胞集落刺激因子(G-CSF),然后分离自体BMSC,在腹腔镜引导下注入卵巢动脉。他们报告了一次成功怀孕和86.7%接受治疗的女性的荷尔蒙水平总体改善。18名女性发生了自发排卵,而3名女性接受了体外受精。
Herraiz等人报道了他们对一组15名卵巢反应较差的女性进行的研究,这些女性接受了10mg/kg/天的G-CSF皮下给药5天,以促进干细胞动员到外周血,然后通过单采术收集干细胞。外周血中通过CD34评估的循环干细胞水平≥10个细胞/μL。细胞通过动脉内导管插入卵巢动脉,导致81.3%女性的卵泡计数提高,妊娠率提高 33.3%,5例妊娠和3例活产。与其他类型的干细胞类似,BMSC 或BMSC分泌组可用于治疗POI显著的结果已在人类身上得到证实,我们相信这些结果可能会给未来的许多患者带来希望。然而,需要更大规模的临床试验来证实这些发现。
通过以上这些实验,我们可以明确得知:采用干细胞移植的方式,可以修复卵巢,用于治疗卵巢早衰安全有效。同时也可改善更年期症状,逆转女性衰老。干细胞技术将为卵巢早衰患者带来生育希望,为提高生育力贡献重要力量。
参考资料:
Ulin, M., Cetin, E., Hobeika, E. et al. Human Mesenchymal Stem Cell Therapy and Other Novel Treatment Approaches for Premature Ovarian Insufficiency. Reprod. Sci. 28, 1688–1696 (2021). https://doi.org/10.1007/s43032-021-00528-z.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号