简介:干细胞疗法在中国已经从临床到临床进行了数十年的积极研究,近年来,干细胞疗法的临床试验在中国蓬勃发展,因此其治疗潜力引发了巨大的热情和期待在医疗需求未得到满足的各种疾病和伤害中。
但是,与其他国家和地区一样,由于干细胞疗法与其他疗法(如小分子药物和生物制剂)在来源、体内作用、临床方案和医疗准备等。
2015年,原中国国家卫生和计划生育委员会(NHFPC,原名卫生部 [MOH])阐明了干细胞疗法的临床转化方法;而现在的国家卫生健康委员会 [NHC])和中国食品药品监督管理局(CFDA,前身为国家药品监督管理局 [SDA];现为国家药品监督管理局 [NMPA]),在接下来的几年中,为满足生物技术利益相关者日益增长的需求并促进干细胞疗法的发展,起草了几项基于干细胞的产品的技术指南。在此,我们简要介绍了中国干细胞疗法的发展和监管框架,以及临床评价问题。
国内干细胞治疗监管框架的发展
近三十年来,中国对干细胞疗法的监管观念已经演变,伴随着国内研发(R&D)概况的发展,并考虑确定此类疗法是否应作为医疗产品进行管理。
细胞与基因治疗于1993年5月首次进入监管部门的视野,此前卫生部发布的《人体细胞治疗与基因治疗临床研究质量控制的首要考虑》解释了细胞与基因治疗在药品管理法(DAL)的监管范围内,此类产品的临床试验只有在获得卫生部审查和批准后才能进行。此后,《新生物制品审评审批办法》(1999)和《人体细胞治疗产品研究和质量控制指南》(2003)进一步详细说明了申请审批程序和技术考虑。
继1998年成立SDA之后,负责监管包括细胞疗法在内的医疗产品。从那时起,允许在临床试验中研究几种细胞的产品,包括间充质干细胞 (MSC) 和自体免疫细胞。之后,这些产品中很少有成功地为其安全性和临床益处提供令人信服的科学证据,而且它们都没有被批准上市。与此同时,许多医疗机构和医生规避法规,暗中使用未经证实的干细胞疗法治疗患者,并谎称他们的疗法研究,导致患者混淆,并推动评估干细胞产品的利益-风险状况所需的严格监控的临床试验。

2009年3月卫生部实施《医疗技术临床应用管理办法》后,干细胞治疗的监管框架与医疗技术相适应,将各种干细胞的治疗归为“III类”。医疗技术——那些被认为“存在伦理问题且仍需要临床验证”的技术。根据该规定,任何“三类”医疗技术在临床使用前均应经过临床试验验证,并经过卫生部的审查程序,医疗机构不得申请“三类”医疗技术。经卫生部审批。
同时,卫生部于2009年6月公布了允许临床应用的“三类”医疗技术清单,其中包括自身免疫细胞(T细胞、NK细胞)疗法和造血干细胞移植等细胞疗法。造血干细胞以外的干细胞疗法虽然未列入许可清单,应按规定停止,但在接下来的一段时间内继续增长。为规范混乱局面,卫生部建议全国暂停干细胞临床研究和治疗,并要求开展为期一年的专项行动,重点检查和整顿未经证实的干细胞治疗临床研究或应用。
干细胞治疗监管新纪元始于2015年7月,国家食品药品监督管理总局和国家卫计委联合发布《干细胞临床研究管理办法》(AMSCCR),详细规定了干细胞临床研究的规则。《干细胞临床研究管理办法》是我国第一个以干细胞临床研究管理为重点的官方文件,取消了以干细胞为基础的“三类”医疗技术的认证和临床使用,并明确医院自备干细胞临床研究只能在具有药物临床试验资质以及合法且充足的干细胞研究经费支持的三甲级医疗机构(国内一流医院)进行。负责干细胞制备和临床研究的医疗机构,机构不得向受试者收取参加临床研究的费用,不得发布或伪装干细胞临床研究广告。
根据AMSCCR的规定,开展干细胞临床研究的研究者应当向国家卫计委和国家食品药品监督管理总局备案医疗机构和临床研究项目的资料,并在中医药注册管理系统进行临床研究在线登记。国家卫生计生委和国家食品药品监督管理总局共同成立了国家干细胞临床研究专家委员会和伦理委员会,对材料进行审查,并会同该委员会的省级分支机构进行现场监督。备案材料经组委会受理后,方可开展临床研究。值得注意的是,不允许在临床研究后将医院准备的干细胞疗法用于临床。临床研究结果可以作为研究证据提交给CFDA,用于商业研究新药(IND)申请的评估。
此外,AMSCCR不适用于技术规范经验丰富的造血干细胞移植和直接向CFDA申报的干细胞产品的临床试验。干细胞产品的商业IND和临床试验由DAL监管,并附有CFDA发布的DAL实施措施(图1)。
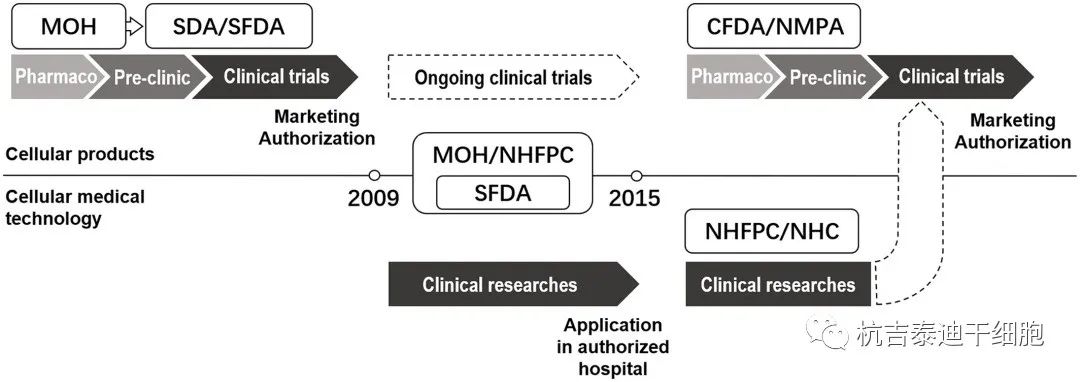
中国细胞医学的监管框架发展
近几十年来,政府进行了几次重建。2008年至2013年,SFDA隶属于卫生部。CFDA,中国食品药品监督管理总局;卫生部,卫生部;NHC,国家卫生健康委员会;国家卫计委、国家卫生计生委;NMPA,国家药品监督管理局;SDA,国家药品监督管理局;SFDA、国家食品药品监督管理局
MHC注册的干细胞临床研究概况和NMPA批准的干细胞产品临床试验
截至2020年底,已有100多家医疗机构和干细胞临床研究项目通过AMSCCR注册成功。这些临床研究在中国一半以上的省份进行,最丰富的是华东地区,包括上海、广东、北京和湖北等。(图2A)绝大多数(83.3%)的临床研究都在探索MSCs ,其他类型的细胞包括神经元干细胞、视网膜色素上皮细胞、羊膜上皮细胞、支气管基底细胞和巨核细胞祖细胞。
MSCs主要来源于脐带组织和胎盘组织、骨髓、经血和脂肪组织,也有其他来源包括胚胎干细胞和牙髓(图2B)。而除间充质干细胞外,其他干细胞的来源包括胚胎干细胞、羊膜组织和支气管基底层等自体组织。这些干细胞的临床研究涉及的适应症种类繁多,一般涉及各种器官系统的疾病,主要是消化系统、泌尿生殖系统、呼吸系统、神经系统、皮肤和皮下组织、内分泌系统、循环系统、肌肉骨骼系统和结缔组织等。
自COVID-19大流行爆发以来,干细胞的疗法也在治疗严重的 COVID-19相关肺炎和急性呼吸窘迫综合征方面进行了测试。值得注意的是,与免疫细胞疗法的肿瘤聚焦趋势相反,2C)。
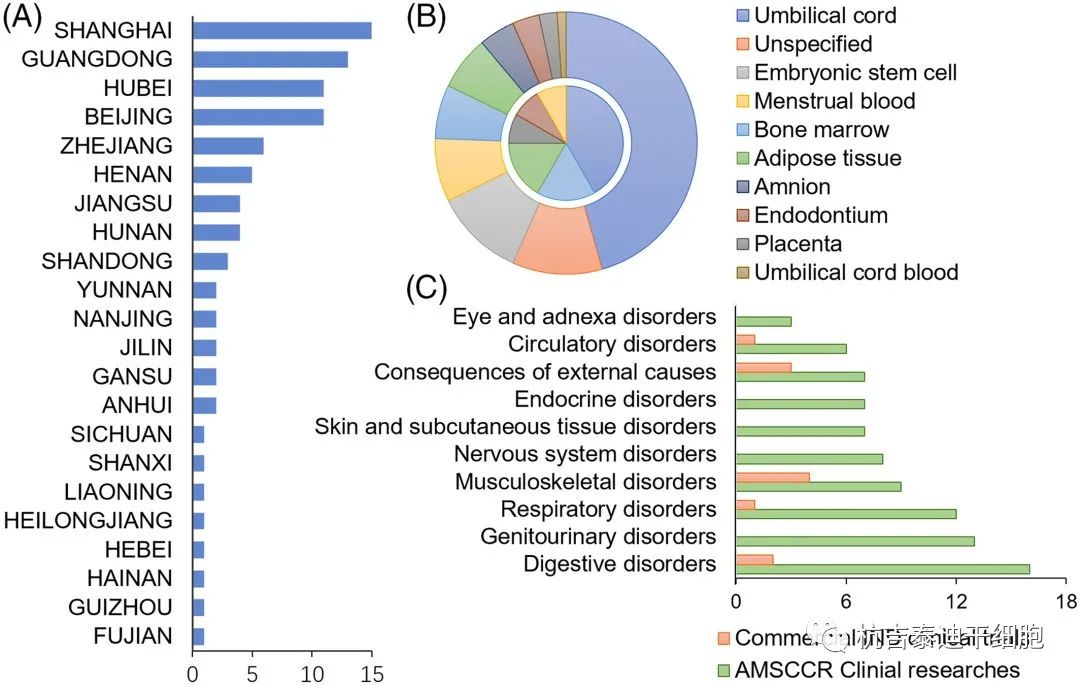
2020年底AMSCCR临床研究和干细胞产品临床试验概况,(A)AMSCCR临床研究的地域分布。(B) AMSCCR 临床研究(外环)和商业IND临床试验(内环)中干细胞的起源。(C) 干细胞研究中探索的患者群体。AMSCCR,干细胞临床研究管理办法;IND,在研新药
另一方面,干细胞产品的研发在中国蓬勃发展。自2019年起,NMPA启动了干细胞和基因治疗产品监管科学行动,以完善此类先进治疗产品的监管框架,此后发布了有关干细胞产品开发的若干指导意见或规划。自AMSCCR实施以来,已有数十家干细胞产品申办者与负责在研药物审评的国家药监局药品审评中心(CDE)进行了沟通。来自脐带、骨髓、脂肪、胎盘、月经或牙髓的10多种MSC产品的临床试验应用已获得CDE授权。值得注意的是,这些项目中的大多数也根据AMSCCR进行了注册,并且这些临床试验中探索的适应症谱——包括膝关节骨关节炎、移植物抗宿主病、糖尿病足溃疡、缺血性中风、溃疡性结肠炎、慢性牙周炎或特发性肺纤维化——与他们的对应临床研究一致。
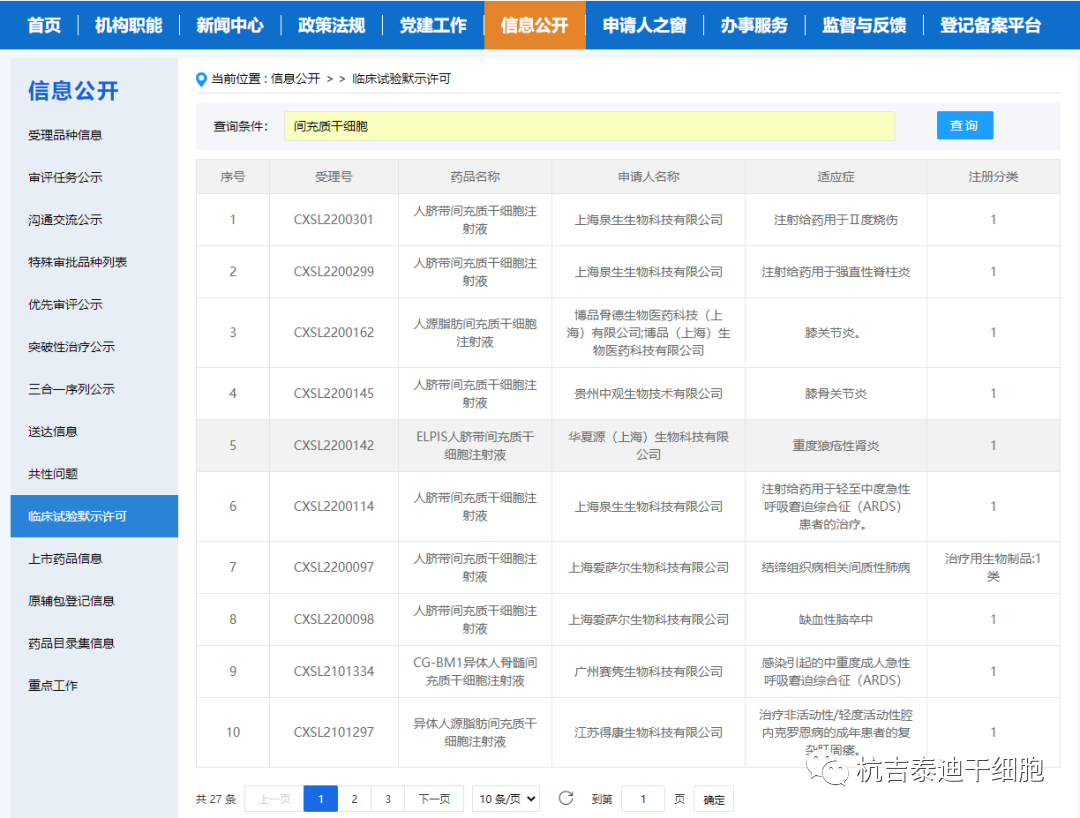
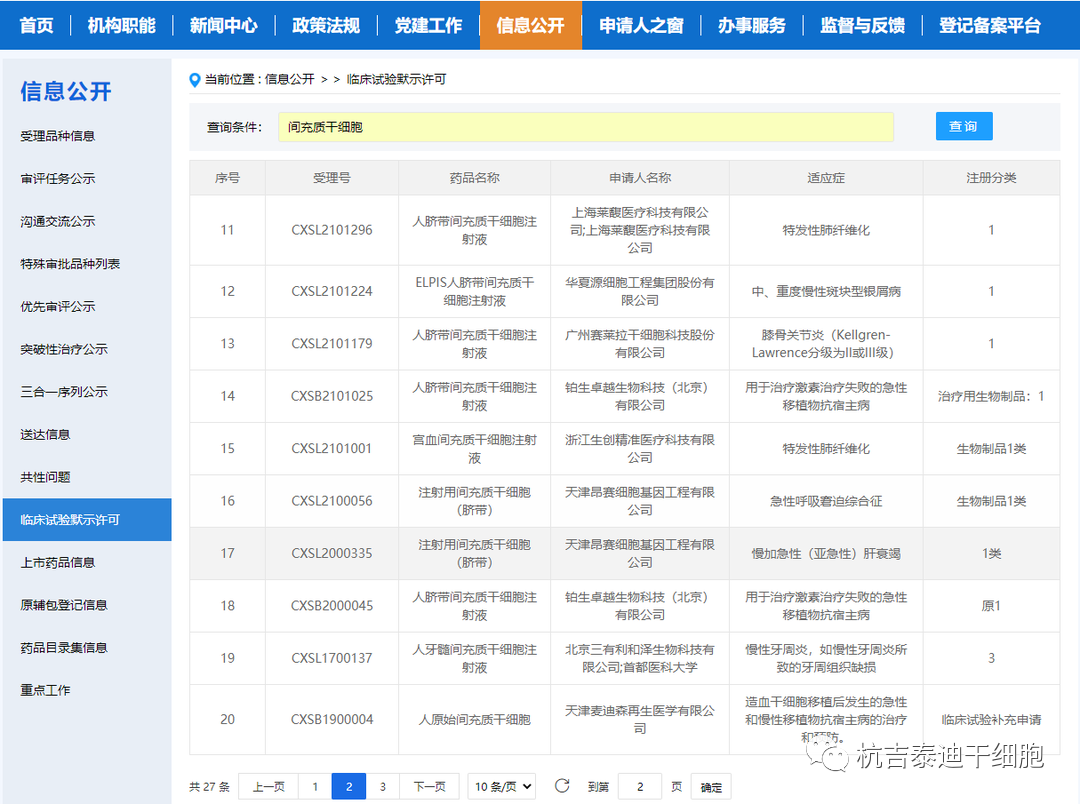
尽管源自这些注册的基于干细胞的临床研究的信息不能作为AMSCCR规定的药物评估证据毫无疑问地被接受,但CDE普遍承认这些信息在初步了解测试产品的临床效益-风险概况和开发以市场为导向的临床试验计划。如果在根据AMSCCR注册的临床研究中发现某些基于干细胞的产品的剂量递增效应,则对于普通IND申请而言,剂量发现试验可能不一定要重新进行。实际上,在AMSCCR研究中获得的安全信息,很少有干细胞的研究产品被允许进入II期临床试验。
中国干细胞产品临床试验注意事项
确定的临床获益是干细胞产品在中国获得上市许可的前提。细胞和基因治疗产品与其他药物产品在临床试验的不同阶段通常具有共同的原理和目的,即探索研究产品在早期临床试验、后期治疗方案和效益风险概况中的剂量递增、安全性和耐受性在晚期确认性临床试验的目标人群中。然而,干细胞产品的临床试验也有明显不同的考虑。
伦理审查
人类生物医学研究的伦理共识已经建立,而与其他药物产品相比,人类干细胞研究在生物材料捐赠、细胞来源、干细胞临床试验监督等方面存在更多伦理困境。国际干细胞研究学会等学术团体就干细胞研究的基本伦理原则提出了不断发展的科学观点,例如研究企业诚信、自愿知情同意、患者福利、透明度和社会正义,我国干细胞临床研究伦理审查中也有相关内容,详见《人体临床研究伦理审查委员会建设指南》。
首次人体研究
临床前概念验证研究对于了解干细胞的产品的作用机制、增殖、分化和迁移等生物学特性以及致瘤性等安全性问题至关重要,对确定干细胞产品具有重要意义。尽管跨物种生理差异和免疫学不相容性可能是准确推断体内细胞行为的障碍,但临床研究的交付方案和预测人体的分布和作用。为基于干细胞的疗法创建一组信息更丰富的动物模型可能有助于克服这些缺点。
首次人体临床试验应谨慎开始剂量递增方案和间隔给药,以避免受试者同时暴露于不合理的并发症。对于应递送至病变部位而不是全身给药的基于干细胞的产品,递送系统的可行性和生物相容性,例如血管内导管插入术或心脏和中枢神经系统疾病的手术注射,也应与细胞。此外,建议对活细胞进行临床跟踪,因为它有利于展示干细胞在体内的生物分布、移植和清除。
收益-风险评估
以干细胞为基础的产品已在中国广泛的适应症中进行了调查。在临床效益评估中推荐与临床实践指南或共识一致的终点。未经证实或替代的终点,例如细胞因子或生物标志物的变化、减少或停止伴随治疗,通常不被接受为确认性临床试验中的主要疗效评价标准,除非这些终点与患者临床获益之间的相关性已得到证实.
作为一种活的药物,基于干细胞的产品通常在体内存活很长时间;重复使用基于异基因干细胞的产品可能会诱发免疫反应,从而降低其有效性和/或增加安全风险。因此,干细胞产品的效益风险评估关注疗效持续时间,需要持续监测和长期随访以避免延迟反应的可能性,例如治疗后的肿瘤形成。
结论
近年来,干细胞的治疗已成为我国极具发展前景的生物医学研究课题。随着对干细胞研究的科学、社会和伦理方面的理解不断加深,中国的监管框架在过去几十年中不断发展。尽管在国内和许多其他国家,监督和促进干细胞治疗发展的最有效方式仍远未完善,但以患者为中心的评估对于患者保护和临床利益风险评估至关重要系统。
致谢
这项工作得到了中国药品监管科学行动计划的支持。科学家和专业人士为改善中国再生医学监管所做的贡献受到高度赞赏。
参考资料:Glyn N. Stacey, Jingyi Cao, Baoyang Hu, Qi Zhou, Manufacturing with pluripotent stem cells (PSConf 2021): Key issues for future research and development, Cell Proliferation, 10.1111/cpr.13301, 55, 8, (2022).
作者:高建超,高晨艳
国家药品监督管理局药品审评中心生物制品临床评价办公室,
中国北京中国北京市朝阳区建国路128号国家药品监督管理局药品审评中心生物制品临床评价办公室
说明:推文用于传播知识,分享行业动态,不构成任何医疗和投资建议,如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号