系统性硬化症 (SSc) 是一种罕见的自身免疫系统性疾病,其特征在于三个主要功能障碍:自身免疫反应、血管病变和组织纤维化。结果是微血管逐渐丧失,皮肤和内脏器官(包括肺和胃肠道)纤维化。呈现的第一个也是最常见的症状是雷诺现象,这是血管功能障碍的直接征兆,通常并发指溃疡 (DU),这是SSc患者的主要负担之一。血管病变的另一种表现是肺动脉高压,连同广泛的皮肤和内脏器官纤维化,导致SSc患者的残疾和死亡率增加。
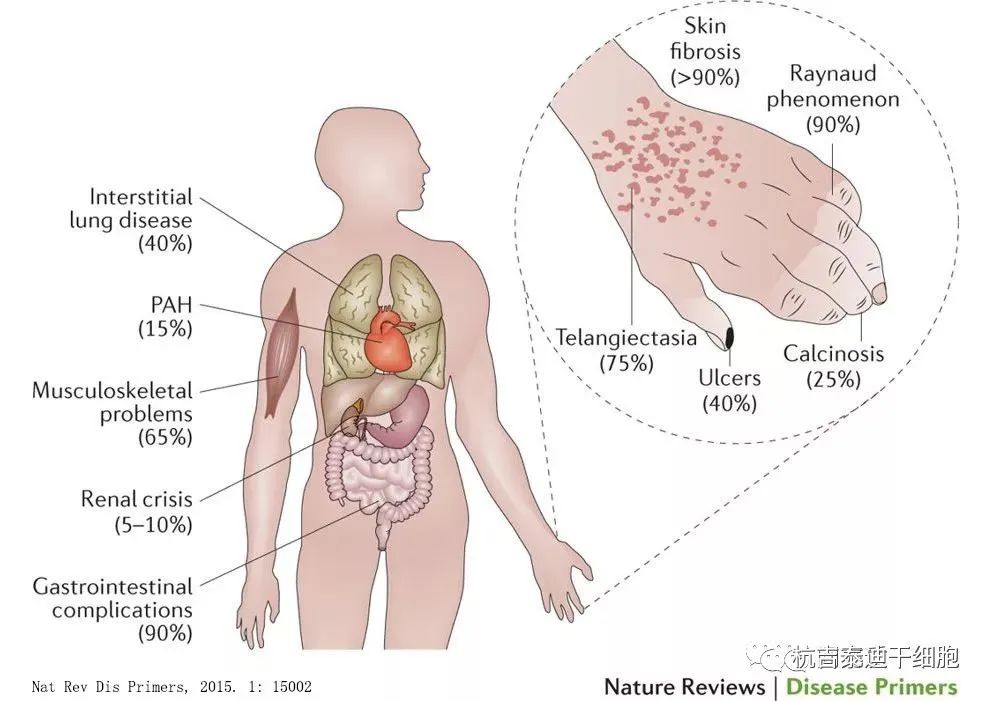
系统性硬化症的发病机制
该疾病的发病机制很复杂,但在了解所涉及的机制方面已经取得了实质性进展。据推测,在遗传易感人群中,环境因素会导致细胞因子释放、免疫细胞激活和结缔组织修复失调。事实上,在SSc患者中观察到的纤维化变化可能是由于结缔组织对氧化应激等损伤的反应功能失调。涉及广泛的细胞成分,主要是内皮细胞、间充质细胞以及T和B淋巴细胞。纤维化是由肌成纤维细胞产生过多的胶原蛋白和其他细胞外基质蛋白引起的。内皮细胞向肌成纤维细胞的转变是由活化的B和T细胞(IL-6、IFN-α、IL-10、TGF-β、PDGF)释放的细胞因子诱导的。
目前,SSc被认为是无法治愈的。最近引入的生物疾病改善药物 (DMARDs) 和抗纤维化疗法提供了更多的特异性和有效性。然而,此类疗法通常只能减缓疾病进展,很少逆转疾病表现。此外,维持治疗会使患者暴露于副作用,例如感染,并且可能与合并症的累积风险有关。在出现广泛且不可逆的损伤之前,需要重新设置自身免疫致病机制,这导致了从动物模型到临床实践的许多努力,以开发能够恢复自我耐受性的细胞的疗法。除了它们的耐受特性外,细胞疗法还显示出一种有趣的潜力,即能够修复已经受损的组织的再生疗法。
系统性硬化症的细胞疗法:从造血干细胞移植到干细胞疗法
在这里,我们回顾了有关干细胞疗法治疗系统性硬化症的现有文献,从临床前模型到临床应用,以及在其他自身免疫性疾病中采用的方法,这些方法可能对系统性硬化症患者的未来研究感兴趣。
造血干细胞移植
造血干细胞移植(HSCT)在治疗血液系统恶性肿瘤方面具有巩固的作用。20多年来人们对其在自身免疫性疾病治疗中的应用越来越感兴趣,由于三项阳性RCT,自体造血干细胞移植现在被认为是难治性系统性硬化症的标准疗法。
HSCT是一个多步骤程序,旨在用源自HSC的新系统替换患者的造血系统,该系统可以从健康供体(异基因HSCT)或同一患者(自体)收集。移植物可以进行CD34选择以富集HSC并可能去除自身反应性淋巴细胞,或者可以在未经操作的情况下注入。自身反应性免疫细胞的消融是通过预处理方案实现的,其强度变化很大,从完全到非清髓性不等,通常包括抗胸腺细胞球蛋白 (ATG)。
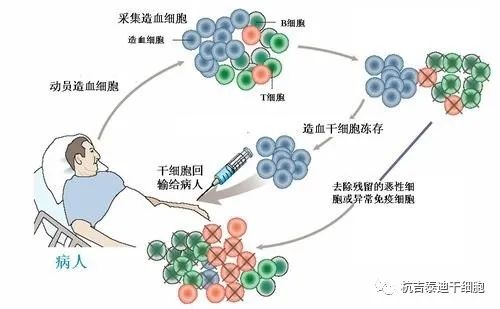
自体造血干细胞移植治疗自身免疫性疾病的基本原理是重置功能失调的、自身反应性免疫系统,以恢复更天真的、自我耐受的免疫系统。
造血干细胞移植治疗系统性硬化症的临床案例
在SSc的初步报告中,arge及其同事在一项I-II期研究中记录了12名患者自体造血干细胞移植的安全性和临床益处。观察到所有患者的造血功能恢复,11名可评估患者中有8名取得了显著的临床反应。
在取得这些有希望的初步结果之后,针对干细胞疗法进行了三项随机对照研究,将自体造血干细胞移植与标准免疫抑制疗法进行了比较。
II期ASSIST试验将19名SSc患者随机分配接受非清髓性、未经处理的HSCT或每月一次的环磷酰胺治疗。与环磷酰胺标准免疫抑制后缺乏显著的长期益处相比,造血干细胞移植组的所有患者均表现出皮肤和肺部改善。值得注意的是,间质性肺病长期以来被认为是不可逆的,在造血干细胞移植后可能至少部分逆转,移植后数年观察到持续改善。
最近,一项纳入80名SSc患者的非干预性前瞻性研究结果表明,自体HSCT后2年无进展生存率为81%。通过多变量分析,较高的基线皮肤改良Rodnan皮肤评分和较高的移植年龄已被确定为较低无进展生存期的预测因子,而移植物操作CD34选择与较好的反应相关。CD34移植物选择的必要性是有争议的。一些研究报告说,与未经处理的移植相比,CD34选择的移植改善了临床结果和更好的无进展生存期,具有相当的毒性和感染率,而其他研究则没有显示出任何显著差异。
到2022年5月,已有776名系统性硬化症患者在EBMT登记处接受了造血干细胞移植治疗(图1)。虽然自体HSCT被认为是一种标准的治疗选择,但由于移植相关并发症的风险较高,使用同种异体造血干细胞移植治疗系统性硬化症仍然是传闻。需要降低毒性的HSCT平台来进一步研究和扩大AD患者的同种异体手术。
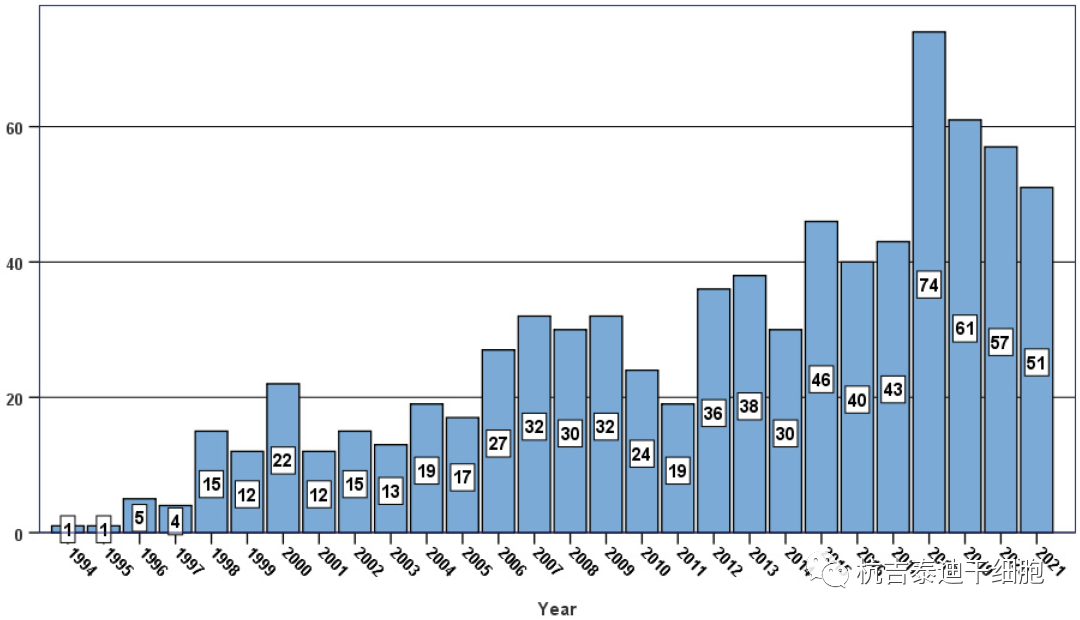
除了造血干细胞移植,其他具有免疫调节特性的创新治疗策略也在自身免疫性疾病的背景下进行了研究,包括干细胞疗法(图2)。
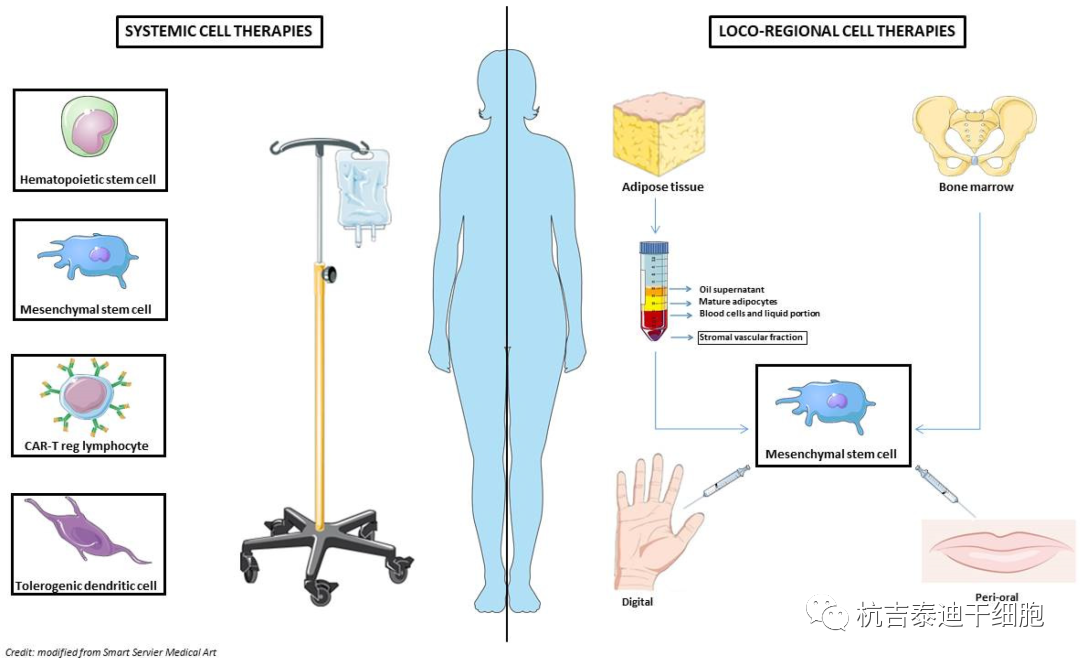
间充质干细胞治疗系统性硬化症具有的临床潜力
间充质干细胞是一种具有高再生能力的异质基质细胞群,可以在离体分离、培养和扩增,由于其免疫抑制、血管生成和抗纤维化特性,代表了针对SSc的细胞治疗方法的有希望的来源。几十年来,骨髓 (BM) 间充质干细胞一直是MSCs的主要来源。然而,很明显,具有相似生物学特性的间充质干细胞也可以从胎盘、沃顿氏胶、血管、牙髓、真皮和脂肪组织中分离出来。对MSCs的临床兴趣源于它们向中胚层细胞谱系分化的能力,包括成软骨细胞、脂肪细胞和成骨细胞,以及它们通过在细胞外囊泡内分泌营养因子、细胞因子和其他生物活性分子而发挥的旁分泌作用。
不同组织来源的间充质干细胞已被研究用于治疗多种适应症,包括组织损伤、自身免疫性疾病和转移性癌症。已经研究了自体和同种异体MSC的使用。
移植外源性的干细胞可调节免疫反应,对系统性硬化症具有抗纤维化、缓解炎症和减轻血管病变的作用。
静脉注射间充质干细胞
在系统性硬化症的动物模型中,几项体内研究表明,注入MSCs可以限制细胞损伤和胶原蛋白沉积。例如,在SSc大鼠模型中暴露于博来霉素后静脉输注骨髓来源的MSC会导致支气管肺泡灌洗液中组织损伤标志物水平降低,促炎细胞因子水平降低。
鉴于临床前模型中的这些经验,近几十年来已在SSc患者中研究了MSC。已发表的数据仅限于小型病例系列研究或回顾性研究,但均报告了治疗的高安全性和极低的治疗相关死亡率(表1)。
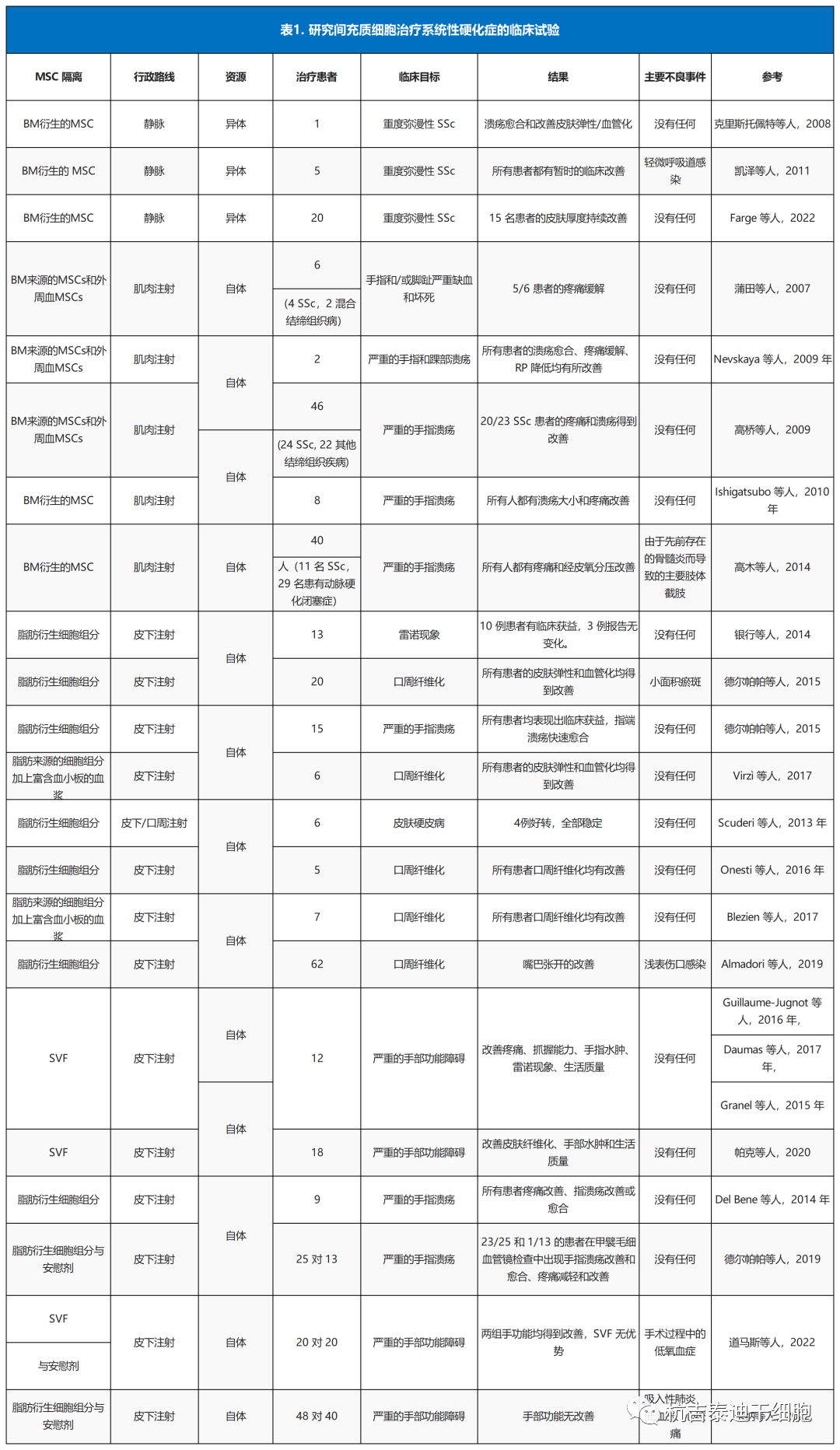
在一项回顾性研究中,Liang 等人研究了来自骨髓或脐带血来源的单剂量静脉注射同种异体MSCs的安全性;该研究重点关注2007年和2016年治疗的404名自身免疫性疾病患者,其中包括39名SSc患者。
主要评估指标是治疗的安全性和耐受性。五年总生存率约为90%,疾病进展或疾病相关并发症是最常见的死亡原因,只有一名患者经历了与治疗相关的死亡。感染率高达30%,其中严重感染约为 13%,据作者称,这不仅可以解释为治疗并发症,还可能部分解释为与疾病相关的免疫功能障碍。
张等人研究了14名SSc患者的血浆置换和异基因MSC移植的组合。根据研究设计,患者接受重复的血浆置换术,随后进行三次环磷酰胺脉冲和单剂量1×106个细胞/kg体重的MSC。通过血清学检测和器官功能分析测量疗效。作者观察到随访一年后平均改良 Rodnan皮肤评分显著改善,以及部分肺纤维化患者的肺功能测试显著改善。抗Scl70自身抗体、VEGF和TGF-β的水平随着时间的推移而降低。
最近,Farge等人报道了20名对免疫抑制治疗或HSCT反应不足或有禁忌症的患者使用骨髓来源的MSC。MSCs注入剂量为每公斤体重1×106或3×106。输液总体耐受性良好,没有与治疗相关的严重不良事件。15名患者作出反应,在皮肤厚度方面具有临床益处。
也有小病例系列报道,均显示至少暂时的临床改善。最佳细胞剂量、给药时机以及来源(自体与异体)仍然存在争议,需要进行大规模的前瞻性临床研究。Van Rhijn-Brouwer报告了一项随机、安慰剂对照研究提案(MANUS试验,NCT03211793)的开放,该研究提案使用肌肉内MSC注射对20名患有标准治疗无效的DU的SSc患者进行。
其他研究已发布在clinicaltrials.gov上。
同种异体间充质干细胞输注治疗系统性硬化症的注册号位(NCT05016804、NCT04432545、NCT04356287、NCT02213705)。
干细胞移植治疗系统性硬化症的开放性问题和未来展望
系统性硬化症的生物学复杂性和临床异质性对寻找最佳治疗方法提出了若干挑战(图3)。自身反应性B细胞和T细胞克隆以及适应性和先天免疫系统的失调在疾病发病机制中起核心作用。已经研究了几种针对它们的治疗方法。
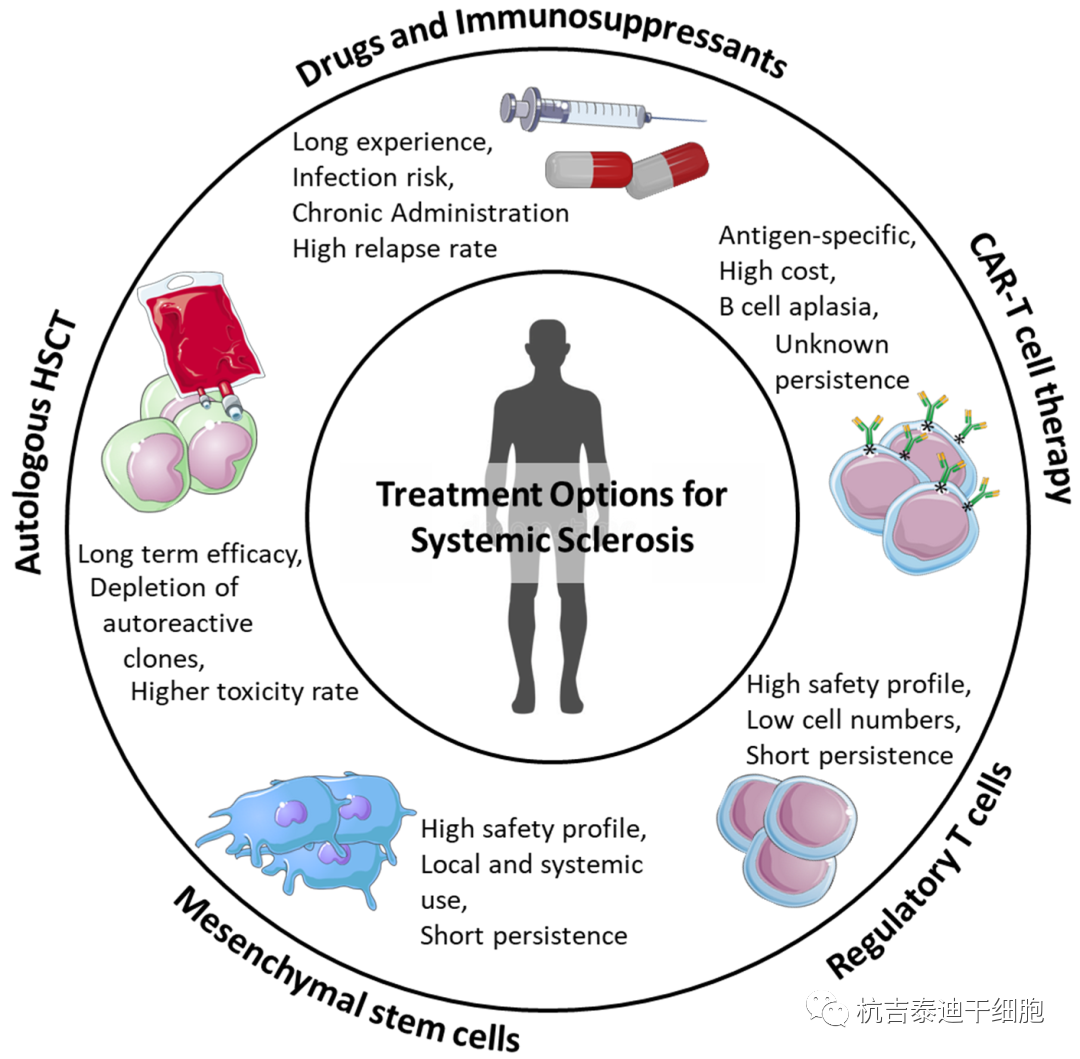
缺乏有效的治疗方法引导了几种方法开发能够恢复自我耐受性的基于细胞的治疗方法。已在SSc患者中研究了自体造血干细胞移植,以获得对自身反应性细胞的深度免疫消融。几项III期试验证明其在长期疾病控制方面优于标准免疫抑制药物。然而,接受HSCT的严重心肺功能障碍患者发生移植相关发病率和死亡率的风险较高,因此,我们可以推测应该在心肺功能障碍发展之前的疾病早期提供HSCT。适当的患者选择和对患者量身定制的低强度预处理方案的研究代表了SSc移植中的重要步骤。
努力研究其他非移植、细胞疗法至关重要。其中,间充质干细胞引起了人们极大的兴趣:除了它们的耐受特性外,间充质干细胞治疗系统性硬化症显示出巨大临床潜力,能够修复已经受损的组织,而不会产生继发于预处理方案和HSCT发育不全的潜在毒性。在I期和II期研究中研究了间充质干细胞的局部和全身使用,记录了它们在稳定或改善疾病方面的整体安全性和潜在功效。
系统性硬化症的治疗是一个不断发展的领域,目前正在评估新的方法中。间充质干细胞的治疗应该是一种安全且潜在有效的治疗选择。
参考资料:
Xue, E.; Minniti, A.; Alexander, T.; Del Papa, N.; Greco, R.; on behalf of The Autoimmune Diseases Working Party of the European Society for Blood and Marrow Transplantation. Cellular-Based Therapies in Systemic Sclerosis: From Hematopoietic Stem Cell Transplant to Innovative Approaches. Cells 2022, 11, 3346. https://doi.org/10.3390/cells11213346.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号