近年来,细胞疗法为疾病的再生治疗带来了巨大希望。尽管最近在临床研究方面取得了突破,但将细胞疗法应用于受伤的大脑并未产生预期的结果。
2022年八月中旬,瑞士苏黎世大学再生医学研究所在国际期刊《The Neuroscientist》发表一篇细胞疗法在修复脑部疾病中的文献,该文献总结了干细胞疗法在脑部疾病中的局限性,并提出了五项原则来推进干细胞疗法的脑再生。文献侧重表达中风的细胞疗法,但细胞疗法也同样适用于其他脑部疾病。

中风是全世界残疾和死亡的主要原因,目前没有可用的再生疗法。已经针对大脑以外的许多疾病领域建立了基于干细胞的疗法,并取得了显著成功。然而,大脑和中风病理学的异质性对将临床前研究的有希望的发现转化为临床现实提出了挑战。在这里,我们确定了五个主要限制,并利用细胞和基因工程领域的最新发展为解决方案提供了建议(图1)。

BM=骨髓;ESC=胚胎干细胞;iPSC=诱导多能干细胞;MSC=间充质干细胞;NPC=神经前体细胞;NSC=神经干细胞;PBMC=外周血单核细胞。
第一原则:细胞来源
各种细胞来源被认为可以成功实现脑再生细胞治疗,包括成体干细胞、胚胎干细胞或诱导性多能干细胞。然而,所有细胞类型都显示出其适用性的局限性。
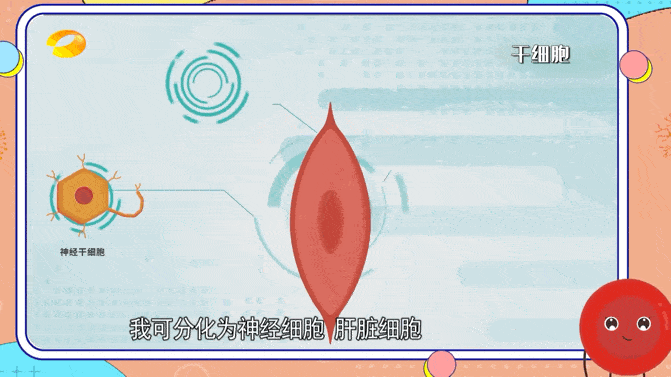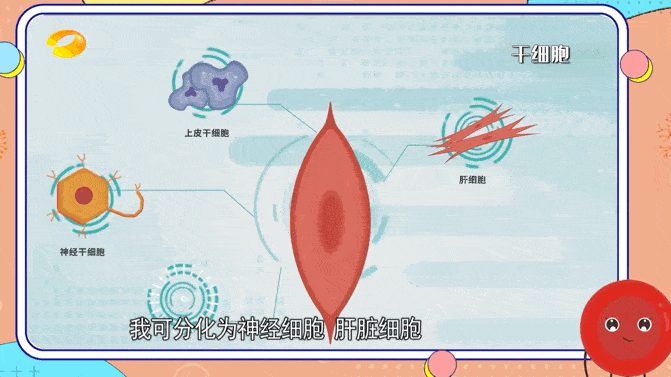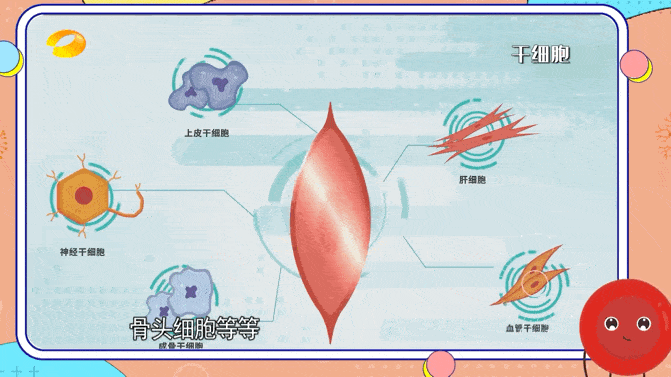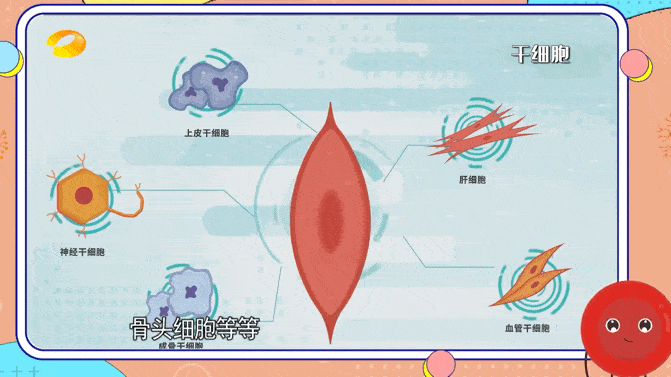
临床上,最常用的成体干细胞来源是原代间充质干细胞,因为它们易于获取且易于分离。
间充质干细胞可能提供营养支持但不分化成神经谱系;因此,它们不能用作大脑中的细胞替代疗法。原代神经干细胞可以整合到受损的神经网络中,但很难获得,因为它们通常是从接受癫痫治疗神经外科手术的个体的颞叶或脑室下区提取的。
神经干细胞可以来源于流产的胎儿组织,并在永生化后进行克隆扩增。与成体干细胞相比,胚胎干细胞具有更强的分化成多种细胞类型的能力,并且可以无限繁殖。然而,由于需要胚胎,它们受到严重的伦理问题。
随着iPSC的引入,伦理问题已经得到解决。iPSC是通过各种重编程因子的异位表达将体细胞重编程为多能胚胎干细胞样状态而产生的。在移植之前,iPSC通常会分化为所需的神经细胞类型,以促进大脑再生。由于具有复杂树突的成熟神经元不适合细胞移植,因此首选使用神经前体细胞。
第二条原则:给药途径
如果移植物不能到达受影响的脑组织,那么生成最适合脑再生的细胞源意义不大。尽管目前的临床前细胞治疗研究倾向于大脑局部移植,但超过一半的临床试验更倾向于通过全身血液注射来管理细胞。
该领域面临着一个困境:局部实质内细胞移植有望获得最大疗效,但注射的相关风险阻碍了其广泛应用。此外,全身注射是微创的;同时,大多数细胞最终会进入不需要的器官,因此治疗效果远远达不到预期的效果。
同时根据细胞类型、脑损伤的时间和严重程度以及相关的血脑屏障 (BBB) 损伤而异等,最终移植细胞实际到达大脑中实际数量也有差异。 在大脑内,为了确保移植后足够的细胞数量到达大脑损伤部位。科研人员开发了多种联合疗法。例如,局部移植时,最有利的方法被证明是移植物的水凝胶封装,它增强了保留和存活,同时改善了移植物的成熟。此外,嵌合抗原受体T细胞治疗癌症的原则, 结合中风相关肽可以增强损伤部位移植物的归巢,并在全身应用后提供更有针对性和更有效的细胞治疗。我们建议未来将细胞输送到大脑应该系统地应用,并且可能依赖于细胞对损伤环境的遗传或药理学功能化,以改善目标区域的归巢和保留,同时确保注射过程中的低风险。然而,最佳目标仍有待阐明和临床前验证。此外,损伤环境是高度多变的,并且在脑损伤的急性和慢性阶段内可能有很大差异。
第三原则:移植的时机
中风后的标准临床程序是通过酶药物立即恢复血流。尽管这些程序非常有效,但它们仅适用于少数中风病例,并非所有患者都能取得积极成果。
中风后受到撞击的脑组织在急性期形成一个恶劣的环境,具有高水平的炎症、氧化应激、细胞死亡和碎屑,这会降低移植物的存活机会。因此,未来细胞治疗的最佳治疗窗口是在中风后几天到1周开始,以确保移植物的长期存活。对于全身移植细胞来说,因为中风可导致双相BBB打开,并在中风后4至6小时和3天增加传递率;这个时间窗增加了移植物更有效地渗透到受伤部位的机会。
目前细胞因子释放和移植物的直接整合已被证明有助于改善急性中风后的功能恢复,慢性中风后细胞疗法的作用机制尚不清楚。在组织丢失和重塑的这个阶段,通过细胞替代来增强功能恢复不太可能由干细胞完成。
然而,神经和非神经干细胞移植已被证明可以启动血管生成、改变微环境、增强突触活动并促进剩余脑宿主组织中的内源性神经发生。所有这些观察都是基于移植物分泌促进整体功能恢复的再生和可塑性促进因子的假设。在这些因素中,血管内皮生长因子和脑源性神经营养生长因子的释放已被确定为临床前和临床研究中的重要旁分泌机制。
这些研究的一个要点是,在中风后的急性和亚急性期,神经干细胞疗法通过直接替代和营养因子促进功能恢复。在慢性期,细胞疗法的支持作用更可能是改善康复的主要机制。在决定哪种细胞类型可以为个体患者提供最有效的细胞疗法时,这些影响当然也很重要。
第四条原则:免疫相容性
免疫排斥是细胞治疗中的另一个关键问题。自体iPSC疗法(即应用从患者自身体细胞生成的 iPSC)可能是规避此问题的最合适选择。事实上,第一项将自体 iPSC 衍生的视网膜细胞应用于黄斑变性患者的研究并未显示任何移植物排斥迹象。然而,符合良好生产规范 (GMP) 的单个iPSC细胞系的生产及其质量和安全控制需要付出巨大的努力和巨大的成本,严重限制了其临床应用及用于急性疾病的治疗。
京都大学目前正在进行一项使用同种异体iPSC衍生的多巴胺能前体细胞治疗帕金森病的临床试验。然而,这种方法需要长期使用免疫抑制剂治疗。
因此,科学家们尝试能否开发出具有最高免疫相容性的同种异体iPSCs,这样便可以实现iPSCs的商品化应用。其中一种方法就是利用人类白细胞抗原 (HLA) 对基因进行改造。从而创造出具有克服免疫相容性的iPSC。
间充质干细胞因为拥有了低免疫原性,以及对各类免疫细胞,如T淋巴细胞、B淋巴细胞、NK细胞、Treg细胞等增殖、活化的抑制,实现了自带“免疫豁免”的属性,彻底清扫了MSC异体应用可能出现免疫排斥的,自身或者外在的风险,实现临床应用MSC的安全性。在临床上具有十分广阔的前景。
第五原则:风险最小化
基于细胞的再生疗法并非没有风险。因此,移植前后的安全措施至关重要。风险范围包括急性脑出血(在立体定向局部注射时)、细胞凝血或细胞诱发的栓塞(全身注射时)和功能性副作用(如癫痫发作和不自主运动)。从长远来看,最大的担忧是移植细胞形成恶性肿瘤以及移植细胞在不需要的组织中沉积。为了最大限度地降低这些风险,实现风险最小化,未来必须对细胞来源质量控制、细胞移植方案、注射细胞数量和注射途径等进行深入探索,并建立规范化流程。
结论
综上所述,我们认为在可预见的未来,中风的细胞疗法具有增加患者治疗选择的巨大潜力。全身和急性移植物注射最有希望成为适用于一系列中风患者的有效细胞疗法。目前正在开发遗传和药理学工具,以确保精确定位到大脑的受伤区域。总之,中风的细胞疗法前途无限,相信随着细胞疗法进一步改善,未来脑卒中问题能被解决。
参考文献:Rust R, Tackenberg C. Stem Cell Therapy for Repair of the Injured Brain: Five Principles. The Neuroscientist. 2022;0(0).




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号