
付小兵(1960.08.14- )中国工程院院士,创伤和组织修复与再生医学专家,四川省资阳市人。1983年毕业于第三军医大学,马德里大学博士。现任解放军总医院生命科学院院长、教授、创伤外科研究员、博士生导师。担任国际创伤愈合联盟执委、亚洲创伤愈合联盟主席、国务院学位委员会学科评议组成员,国家技术发明奖、国家科技进步奖评委,中国生物材料学会候任理事长、中国博士后基金会理事、中华医学会组织修复与再生分会主任委员、中华医学会创伤学分会名誉主任委员、国家973“创伤和组织修复与再生项目”首席科学家,国家重点研发计划项目负责人,国家自然科学基金创新群体负责人。1995年国家杰出青年基金获得者。(引自搜狗百科)
基于间充质干细胞(MSC)的治疗被认为是针对多种难治性疾病的有前途的方法,因为间充质干细胞具有显著的多种效应,例如多向分化、免疫调节特性和促再生能力。
然而移植物植入不良,移植间充质干细胞存活率低,以及宿主年龄/疾病下供体-MSC潜能受损导致治疗结果还不够令人满意。
增强策略,包括遗传操作、预激活和培养方法的改变,已被研究以产生高功能的MSC。
解放军总医院付小兵院士:提高间充质干细胞疗效,为临床提供满意效果!
中国工程院、解放军总医院生命科学院院长付小兵院士带领团队成员发文总结了目前间充质干细胞预激活的方法并进一步分类,分析了这些操作的科学原理和主要特点,并阐述了各种预激活策略的优缺点。
本文摘录其中部分内容做一分享!
多种不利条件将导致各种问题,例如:
- 移植细胞的存活率低
- 间充质干细胞的迁移和归巢差,并限制了注射细胞的功能。
- 来自不同个体的间充质干细胞在它们的生物学效应上是不同的,如来自老年供体的MSCs显示出增殖和分化受损、免疫调节抑制和生物活性分子分泌减少。
- 再则由于暴露于恶劣的宿主微环境,包括缺氧、氧化应激以及慢性炎症,MSCs可能很快发生凋亡。
- 此外,大多数输注的间充质干细胞滞留在肺微血管而不是靶组织中。
尝试优化干细胞的策略大致分为两类,即基因修饰和非基因修饰(预激活)。
在基因修饰方面,间充质干细胞将产生或过量表达功能基因,使其能够抵抗不利的微环境和凋亡,增加迁移和归巢,并增强旁分泌效应。几项研究表明,基因转染的间充质干细胞比野生型间充质干细胞具有更好的治疗潜力。
然而,安全性是转基因间充质干细胞未来临床治疗应用的最大障碍。据报道,病毒表达系统可以在宿主中引发免疫和炎症反应,并且病毒在宿主基因组中的整合会造成肿瘤风险。此外,基因工程间充质干细胞的治疗潜力和长期功能改善需要充分阐明。
开发高效的非基因修饰方法,在这里统称为预激活,是改善间充质干细胞治疗结果的一种替代和可操作的方法。
间充质干细胞可以被预激活以实现所需的功能并逆转其失活,因为它们可以识别微环境中的刺激并记住它们。
回顾目前的文献,间充质干细胞的预激活主要是基于间充质干细胞存活的体内生理微环境而在体外模拟的,称为“生理微环境模拟预激活”。或者说间充质干细胞的体外适应性调节是基于疾病的病理微环境,称为“病理微环境模拟预激活”。
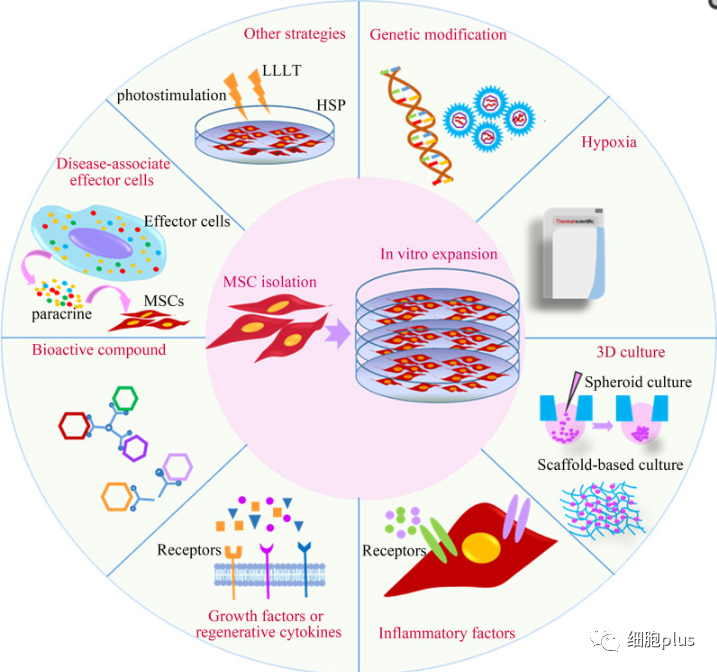
生理微环境模拟预激活
原代培养的间充质干细胞数量有限。它需要在体外扩增以达到治疗相关的细胞数量,过度的离体操作导致衰老、干细胞减少和再生能力受损。
在体外保持MSCs的“年轻”是非常重要的。在这方面,在体外重建复杂的体内微环境将为MSC的生产提供一个强有力的工具,并保持其固有的生物学特性。低氧和三维(3D)培养是迄今研究得最深入的。
缺氧预激活
在体外培养条件下,MSCs通常暴露于平均氧分压约为21%的环境中。然而,间充质干细胞通常存在于低氧微环境中,其生理氧浓度在体内为1-11 %。
几项研究表明,高氧浓度在培养的MSCs中引起环境应激,然后诱导DNA损伤和衰老,并减少他们的活动。因此,缺氧是MSCs生理微环境的重要组成部分。
低氧预激活对间充质干细胞有多种有益作用。包括有:低氧培养环境维持MSCs的未分化状态。
低氧促进了MSCs的增殖和存活,与常氧状态(20% O2)相比,导致了更高的扩增和更多的ASCs产量,在体外迁移试验中,低氧预充促进了MSCs的动员,改善MSCs在体内的归巢。
低氧预充可以保护MSCs对抗不利的微环境,维持基因的稳定性。当暴露于低氧时,MSCs表现出延长的寿命并避免复制性衰老,与常氧培养相比,表达较少的衰老相关β-半乳糖苷酶。缺氧条件下的间充质干细胞表现出基因稳定性,DNA损伤减少,染色体畸变减少。
低氧培养后,MSCs的分泌模式发生变化,旁分泌功能增强。例如,在缺氧条件下,MSCs中促血管生成因子如VEGF、HGF和碱性成纤维细胞生长因子(bFGF)的分泌增加。相反,抗血管生成因子,如血小板反应蛋白-1和纤溶酶原激活物抑制剂-1,在间充质干细胞中减少。此外MSCs在低氧情况下的免疫抑制特性得到改善。
大量实验研究发现,低氧预激活的MSCs比未经处理的MSCs显示出更显著的治疗效果。在肺纤维化模型中,与常氧培养的MSCs相比,低氧预激活的MSCs可以明显减轻肺水肿,减轻肺纤维化,并改善肺功能。此外,与含氧量正常的骨髓间充质干细胞相比,将含氧量低的骨髓间充质干细胞移植入大鼠心肌梗死模型后,损伤部位的血管生成增加,梗死面积减小。
因此,与常氧的MSCs相比,缺氧预处理的MSCs表现出更好的特性并具有更好的治疗潜力。此外,低氧预激活具有简单、成本低、易于推广、适合大规模细胞生产的优点。然而,在低氧间充质干细胞进一步应用于临床之前,有几个问题需要解决。有必要优化低氧预激活中的氧浓度,因为MSCs生活的生理龛中的氧浓度因组织来源而异(骨髓中1%至7%,脂肪组织中10%至15%,出生相关组织中1.5%至5%),此外,还应该揭示缺氧的最佳持续时间。更重要的是,生物安全是基于干细胞的治疗最关心的问题,在临床应用前应仔细确定。
3D培养预激活
与二维(2D)培养环境相比,三维培养系统模拟了体内的天然MSC微环境,并提供了增强的细胞间相互作用或细胞-ECM相互作用,这可以显著改善MSCs的生物学行为,如增殖、免疫调节和定向分化。
MSCs的三维培养体系,包括多细胞球体、支架和水凝胶,已经引起了越来越多的关注。
- 球形培养
球体培养是一种相对简单的增强间充质干细胞生物学活性的方法。已经开发了各种方法来产生MSC球体,例如悬滴技术、低附着方法以及强制聚集技术。随着生物材料的发展,基于支架的MSC球体培养平台得到了发展。
球形培养系统可以通过增加干细胞和促进分化成不同的细胞谱系而有益于间充质干细胞的治疗潜力。Cheng等人的研究结果表明,壳聚糖膜球形培养可使MSCs去分化为更原始的状态,间充质谱系标志物CD29、CD90和CD105下调,多能性相关标志物Sox2、Oct4、Nanog上调。球状体来源的MSCs改变了它们的分化偏好,并可以转分化为非间充质谱系细胞,如神经细胞和肝细胞。
球形培养系统可以通过提高增殖、迁移和归巢效率而有益于MSCs的治疗潜力。与单层MSC培养相比,球体来源的MSC表现出更高的增殖活性。
球形培养系统可以通过促进治疗因子的分泌,包括免疫调节和促血管生成细胞因子,来助力MSCs的治疗潜力。
球形培养优化了间充质干细胞的生物学特性,使其在体内具有更好的治疗效果。
然而,球体培养系统的一些缺点限制了用于体内应用的MSC球体的大规模生产。例如,球体培养技术影响球体大小,球体大小的可变性影响MSCs的治疗性能。因此,在临床实践中使用球体来源的MSC之前,有必要区分临床需求,开发可重复的球体培养系统,并利用动物模型和临床试验来确认其安全性和有效性。
- 基于支架的培养
细胞外基质(Extracellular matrix,ECM)是干细胞生态位的重要非细胞成分之一,被认为是干细胞的“土壤”。
生物材料的最新进展促进了MSCs人工ECM培养系统的发展,出现了多种天然和合成生物材料。它们应该满足基质力学、可降解性和生物相容性的特性。
现有的工程化细胞外基质可以改善间充质干细胞的生物学特性,如增殖、归巢、谱系分化和旁分泌。
支架、薄膜、水凝胶和海绵形式的工程化ECM已被开发并用于扩增MSCs并增强其生物学特性,藻酸盐已广泛用作组织工程中的生物相容性载体。
接种在工程化ECM支架上的间充质干细胞的旁分泌和免疫调节作用也显著改变。接种在生物材料中的MSCs显示出抗炎调节因子如PGE2和TSG-6的上调,以及抗炎调节因子如单核细胞趋化蛋白-1 (MCP-1)、IL-6和核因子κB受体激活因子(NF-κB)配体(RANKL)的下调。
因此,基于支架的三维培养赋予MSCs比2D培养更优异的生物学活性和更突出的治疗效果。随着人们对生物材料的认识,其生物学性能也在不断拓展。仅使用生物材料,就可以制造出具有多种功能的仿生复合材料。
病理微环境模拟预激活
MSC既然进入体内,就会面临疾病导致的病理微环境。在这种情况下,有多种破坏性因素可导致移植细胞的氧化应激和凋亡,并显著损害MSCs固有的治疗特性。
研究人员致力于针对恶劣环境微调细胞的特性,使其适合目标疾病。基于MSCs的可塑性和记忆能力,创伤微环境中的信号,如环境因素(缺氧)、化学因素(炎症因子和细胞因子),将是MSCs体外操作的首要考虑因素。
此外,新的途径也在不断探索,如药物、中药、小分子化合物等也成为MSC启动的新兴途径。
另一个值得关注的问题是,患者内源性MSCs的生物学特性会随着疾病的发展而改变,表现出功能的丧失和下降。
因此,改善间充质干细胞的生物学活性,提高其治疗效果,特别是开发患者个性化的治疗性间充质干细胞具有重要意义。
缺氧预激活间充质干细胞
缺氧也是病理环境的重要组成部分。
体外低氧培养可以诱导MSC对损伤微环境的记忆,从而获得更好的治疗效果。
然而,干细胞龛和受损组织之间的氧浓度是不同的。此外,受损组织中的局部氧浓度在不同的修复期有所不同。因此,干细胞预处理的氧浓度因目的而异。、
炎症因子预激活间充质干细胞
炎症因子和细胞因子的预激活被认为是模拟体内炎症微环境的最常见手段,在调节干细胞的免疫调节功能中发挥重要作用。
- TNF-α
越来越多的证据表明,用疾病相关的刺激对间充质干细胞进行适当的预处理可以改善其生物学功能,起到更好的治疗作用。TNF-α在缺血和损伤组织中表达,通常用于模拟急性炎症环境。
- 干扰素γ
促炎细胞因子IFN-γ也是用于MSC预激活的代表性因子。间充质干细胞对IFN-γ有明显的免疫抑制反应,一些抗炎因子如HGF、TGF-β1、IDO、前列腺素和环氧化酶2 (COX-2)的表达增加。多个证据表明,间充质干细胞可以被炎症信号激活,并足以加强其免疫调节特性和治疗效果。
- 白细胞介素-1β
IL-1β也是单核细胞和巨噬细胞产生的炎症组织中普遍存在的炎性细胞因子。已有研究表明,IL-1β预激活增加了MSCs中许多粘附分子的表达。
- 其他促炎细胞因子和TLR配体
此外,一些其他炎症因子如IL-17A和IL-25最近被报道为替代的预激活手段,并获得了有希望的结果。
- 联合促炎细胞因子
MSCs经各种促炎因子预激活后,其生物学活性各不相同,因此科学家们设想是否可以通过联合不同的炎症细胞因子对MSCs进行预处理,以弥补较低的效率并使治疗效果最大化。
因此,炎症细胞因子预激活不仅可以提高间充质干细胞抵抗氧化应激的能力,还可以在很大程度上增强间充质干细胞的免疫抑制特性,增强其治疗效果。
用生长因子或再生细胞因子预激活间充质干细胞
最近出现了用生长因子或再生细胞因子预充间充质干细胞,并证明是一种有吸引力的方法。如bFGF、SDF-1、SDF-1α、p38丝裂原活化蛋白激酶(MAPK)等。
同样的,用生长因子混合物预激活MSCs显示了增强其生物学功能的协同效应。
然而,选择最佳的细胞因子来预激活MSCs并赋予其所需的生物学功能是一个重要的步骤。是选择在各种疾病中共同变化的细胞因子,还是使用疾病特异性细胞因子作为预激活条件,是一个需要深入研究的问题。或者,细胞因子预激活的方法不够经济,因为大规模生产预激活的MSCs需要大量的细胞因子。
用生物活性化合物预激活间充质干细胞
生物活性化合物是一种很有前途的预激活方法,用于增强间充质干细胞的生物学特性。
目前,用于刺激间充质干细胞的生物活性化合物根据其来源可分为天然(如从中药中提取的)和合成化合物;从生物活性化合物的筛选原理来说,要么对MSCs有生物调节作用,要么对靶疾病有治疗作用;鉴于其对间充质干细胞的生物学机制,生物活性化合物可分类如下:促进存活和迁移,增强分泌活性,逆转和修复受损的间充质干细胞。
- 促进间充质干细胞存活和迁移
实际上,发挥间充质干细胞固有的治疗特性需要移植细胞在恶劣和受损的环境中存活和发挥功能。许多研究集中于通过使用生物活性化合物来修饰MSCs以增强其抗凋亡和迁移能力。譬如曲美他嗪、他达拉非、阿托伐他汀、维生素E等。近年来,中药或其提取物对间充质干细胞的有益作用已被研究。譬如丹参、姜黄素、迷迭香酸(RA)和gigantol等等,都可以发展为细胞保护剂,为成功的间充质干细胞移植。
- 增强间充质干细胞的免疫调节、旁分泌和治疗潜力
事实上,间充质干细胞的免疫调节和旁分泌特性与其治疗效果密切相关。最近的数据表明,药物刺激可以促进间充质干细胞的旁分泌和免疫调节潜力。譬如铁螯合剂去铁胺(DFX)、前列环素类似物曲前列环素、白藜芦醇(Resveratrol,RSV)、补阳还五汤(BHD)等等。
- 逆转和修复受损间充质干细胞
随着体外大规模扩增,来自围产期组织的MSCs将发生复制性衰老,来自老年供体的MSCs普遍呈现早衰表型,来自患者的MSCs表现出MSC生物学功能的下降。这些间充质干细胞通常在增殖、迁移、分化和免疫调节方面表现出下调的细胞功能,治疗能力受损。因此,逆转这些间充质干细胞的功能,即间充质干细胞的再生,对于基于间充质干细胞的治疗至关重要。幸运的是,最近的研究表明,细胞功能衰退或早衰是可以挽救的。一般来说,拯救MSCs的方法可以广义地定义为降低细胞内氧化应激的水平,可以通过表观遗传修饰的调节来重编程MSCs,以及使用抗衰老药物等。
- 抑制过度氧化应激
数据显示,ROS作为细胞代谢产生的天然副产物,在MSCs中维持在低水平,并且对于MSCs的增殖和分化是必需的。在年龄老化或病理条件下诱导的高水平ROS将导致严重的细胞毒性和细胞损伤。几项研究报道,功能异常的MSCs可以通过调节细胞内ROS聚集和氧化代谢而逆转。抗氧化剂已成为自然的选择,几种抗氧化剂用于MSCs的抗衰老研究。如n-乙酰半胱氨酸(NAC)和依达拉奉等。总的来说,ROS可以作为细胞内信使,帮助执行重要的生物功能,不过通过调节抗氧化剂的量来控制ROS的最佳浓度至关重要。
- 改变表观遗传失调
表观遗传调控是一种重要的编程机制,它通过改变基因表达而不是DNA序列来改变细胞表型。其特点是遗传性和可逆性,包括DNA甲基化和组蛋白修饰,并对MSC的命运有深远的影响。与年轻来源的间充质干细胞相比,老年来源的间充质干细胞的DNA甲基化普遍降低。
利用目前的技术,对老化干细胞进行重新编程的方法主要有两种方式,完全重新编程和部分重新编程。前者是指表观遗传时钟的重置,最终获得诱导多能干细胞(iPSCs)。而后者部分重编程涉及不完全去分化,被认为是表观遗传返老还童,这可以通过使用生物活性化合物调节DNA甲基化和组蛋白修饰来实现。
抗衰老药物的使用
抗衰老疗法是指应用抗衰老药物来选择性地消耗衰老细胞或延迟衰老的开始,从而使组织再生并减少与年龄相关的病理的发生。
据报道,一些化合物具有潜在的抗衰作用,如navitas (ABT-263)、槲皮素、达那唑、烟酰胺核苷、达沙替尼和二甲双胍。不同药物的组合可以达到更显著的疗效。譬如一些发现表明,达沙替尼和槲皮素的混合物可以减轻衰老细胞的负担,并改善重要组织如脂肪、骨、主动脉和脑的功能。
总的来说,这些发现表明生物活性化合物具有改善受损间充质干细胞和修复衰老间充质干细胞的特性。几项研究表明,使用生物活性化合物作为MSC移植的伴随剂也比单独干细胞移植具有更好的治疗效果。然而,间充质干细胞的衰老是一个非常复杂的过程,彻底了解衰老的潜在机制将有助于我们找到更有效的方法来恢复衰老的间充质干细胞。
用疾病相关效应细胞或患者血清预激活间充质干细胞
“个体化间充质干细胞治疗”是指通过体外预激活获得的间充质干细胞具有定制的功能,能够特异性地针对患者的疾病,从而达到更好的治疗效果。因此,作为基于MSC治疗的增强策略,直接使用效应细胞或其释放的活性物质作为预激活条件,而不是用典型的促炎因子、细胞因子或生物活性化合物进行教育。
肥大细胞(MCs)在速发型超敏反应和过敏反应中起重要作用,也是特应性皮炎(AD)发病机制中的主要效应细胞。活化的MCs释放含有大量生物活性物质的颗粒,如促炎细胞因子、蛋白质介质、脂质介质和生长因子,这些物质可引发过敏反应。一些研究表明,在共培养系统中,MSCs抑制MC活化和脱颗粒,并诱导MC凋亡。因此,用效应细胞或其衍生的活性物质预激活的MSCs可以准确地靶向疾病发展中的主要致病因素,并在体内快速反应和应答,以实现更高效的治疗结果。
另外已经在多种疾病中发现血液循环中的炎症因子、趋化因子、生长因子、细胞因子和微泡的改变,包括阿尔茨海默病、肾病和心脏病。它们作为疾病诊断、治疗和预后的指标,以及个体间的差异。用患者来源的血清预激活扩增的间充质干细胞可能允许间充质干细胞对宿主微环境产生积极反应。
Tang等人的研究表明,与注射对照血清预激活MSCs的大鼠相比,注射中风血清预激活MSCs的大鼠在脑缺血再灌注损伤模型中表现出明显改善的行为,炎症细胞因子减少,脑损伤和凋亡细胞减少,营养生长因子增加。
此外,在葡聚糖硫酸钠诱导的结肠炎大鼠模型中也揭示了用疾病来源的血清增强间充质干细胞的治疗效果。在用来自结肠炎大鼠或正常大鼠的血清预激活MSCs后,收集两种预激活细胞的条件培养基用于治疗结肠炎。与后者相比,前者在结肠炎大鼠中显示出更有效地阻止疾病进展,更好地改善临床特征,以及更低的组织学损伤评分。
因此,疾病特异性预激活可能是实现“MSC定制临床治疗”的一种有前途的手段,而准确捕捉疾病特异性是这一策略的必要前提,这就需要对疾病的生物学机制进行全面深入的探索和分析。
远景展望
除了通过重建生理和病理微环境来预激活间充质干细胞之外,还有其他方法来预激活间充质干细胞,包括光刺激、磁电刺激和热休克(HSP)等。
低水平激光疗法(LLLT)有利于调节多种细胞的生物功能。例如,与未受刺激的ASCs相比,受低强度激光刺激的ASCs的生物活性增强,表现为存活率增加、分泌增加和再生愈合加快。此外,最近证明脉冲电磁场通过调节Akt/Ras信号通路和上调Bad和Bcl-xL等存活蛋白对BMSCs起保护作用。此外,研究表明,热休克蛋白可以诱导细胞保护蛋白,增加抵抗不良外部环境的能力。
一般来说,现有的预激活方法的目的是充分利用MSCs的功能可塑性,并预先赋予MSCs所需的特性,以便当MSC再次遇到类似的环境时,启动细胞保护机制,快速激活反应机制,并迅速做出相应的生物反应。
尽管如此,预激活间充质干细胞的应用仍面临一些挑战。首先是选择合理有效的MSC预激活方法。
迄今为止,已经提出了许多补充方法来提高间充质干细胞的治疗效果,寻找最佳的预激活方法是我们未来研究的重要目标。每一个预处理的目标都是改善MSCs的一个特定方面,不同策略的最佳组合可以使MSCs的治疗效果最大化。
二是间充质干细胞的异质性,主要表现在两个方面:一是不同来源间充质干细胞的生物学特性在分化、表型谱和分泌谱方面存在差异,这意味着作为一种新型细胞药物,来自不同组织的间充质干细胞对同一疾病的治疗效果不一致。有必要深入了解每种组织来源的间充质干细胞的独特生物学特性,并结合不同的疾病模型来确定每种间充质干细胞的疾病营养特性。
第三是开发评估预激活间充质干细胞安全性和治疗特性的标准平台。大量研究证据证实,间充质干细胞主要依靠旁分泌发挥生物学效应。MSCs分泌产物的总和可视为分泌组,主要包含可溶性蛋白和细胞外小泡,其中前者包括细胞因子、趋化因子、生长因子,后者可分为外泌体和微泡(图1)。因此,准确地选择一种成分既作为预激活的指标又作为受教育MSCs的治疗效果的指标是一个棘手的问题。然而MSCs的体内生物学机制远比我们想象的复杂,一些抑制和对抗干细胞凋亡作为MSC预激活常用的评价指标是值得斟酌的。
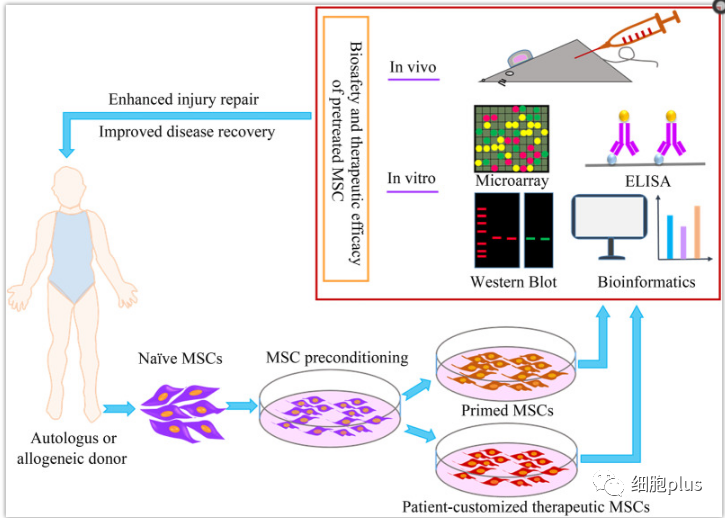
初始间充质干细胞向预处理间充质干细胞向临床治疗转化的周期,预处理的间充质干细胞获得了良好的治疗效果,增强了损伤修复和疾病恢复。
最后,MSC体内治疗的本质是递送促修复调节因子和细胞外小泡等。因此,研究人员已经开始使用MSC衍生的可溶性蛋白质和细胞外小泡来替代干细胞进行治疗,其释放受到精确的调节,并且其组成随着预激活条件而变化。这种方法可以避免MSCs在体内增殖、分化和分泌不可预测的旁分泌因子的风险。最近的研究结果表明,通过密度梯度离心将MSCs去核为“无核细胞Cargocytes‘’,形成了一种生物启发的递送方法。Cargocytes保留旁分泌能力,不增殖,或永久移植在宿主体内。cargocytes的应用不仅避免了与直接使用MSCs相关的不良事件,如肺栓塞或脑栓塞,而且改善了生物分布并增强了体内靶向靶组织的能力。因此,来源于间充质干细胞的干细胞可能成为治疗载体,以可控和有效的方式传递具有治疗疾病潜力的治疗药物。
结论
总之,尽管预激活的间充质干细胞仍然存在问题,但由于其巨大的再生潜力,它们仍然为各种难治性疾病的治疗提供了相当大的希望。
迄今为止,越来越多的人一致认为,在各种病理条件下,预激活的间充质干细胞确实比未激活的间充质干细胞表现出更好的治疗效果。
今后,我们应该有效地利用“预激活”工具,一方面最大限度地发挥间充质干细胞的治疗潜力,另一方面将其改造为适合靶向疾病,为间充质干细胞的临床应用开启新的篇章。(本文由公众号“细胞PLUS”编译,转载请注明)
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号