简介:病毒性肝炎、酒精性脂肪性肝炎、非酒精性脂肪性肝炎、自身免疫等多种刺激因素可引起肝脏慢性炎症的发生,导致肝脏损伤,炎症细胞和肝星状细胞活化,最终导致肝纤维化的发生。随着肝纤维化的加重,机体功能障碍最终会发展为肝硬化,甚至肝癌(图1)。
肝移植和肝细胞移植是治疗肝纤维化的有效方法。但由于缺乏肝脏器官、免疫排斥反应、手术并发症等因素,无法应用于临床。因此,鉴于患者数量不断增加而供体数量有限,以及肝纤维化发病率和死亡率的增加,需要替代疗法。
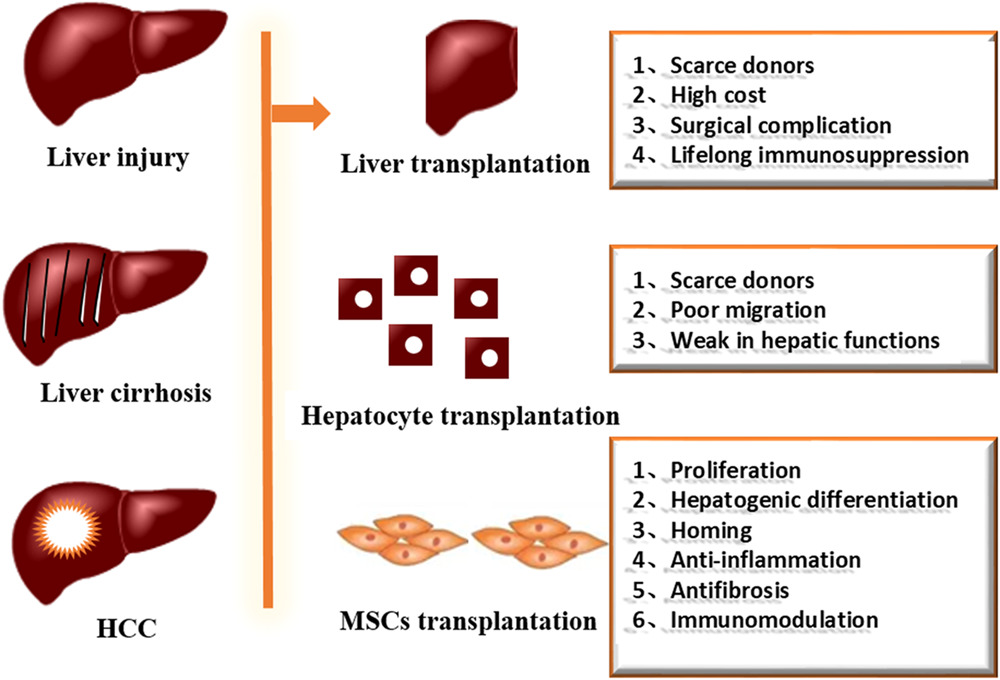
间充质干细胞治疗肝损伤的临床研究进展
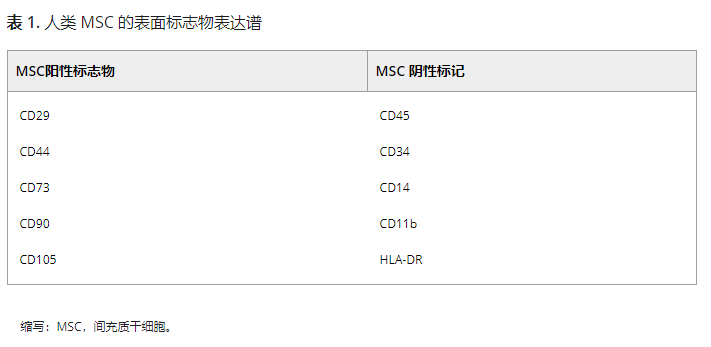
基于间充质干细胞 (MSC) 的肝细胞分化和再生潜力,以及它们的免疫调节特性,已提议将间充质干细胞 (MSC) 用于治疗纤维化。国际细胞和基因治疗学会 (ISCT) 的间充质和组织干细胞委员会提出了一套最小的标准来定义 MSC,其中包括对塑料的粘附、特定表面抗原的表达,以及分化成成骨细胞、脂肪细胞的潜力和软骨细胞。目前公认的MSCs有CD29+、CD44+、CD73+、CD90 +、CD105+、CD45−、CD34 −、CD14−、CD11b−和 HLA-DR−(表1)。
此外,由于MSC易于分离和繁殖、相对安全性、旁分泌因子的分泌以及相互作用和减轻免疫效应反应的能力,间充质干细胞正在800多项临床试验中进行临床研究。
肝纤维化的形成机制
正常肝组织包括肝细胞、内皮细胞、肝巨噬细胞和肝星状细胞 (HSC)。HSC是位于肝细胞和内皮细胞之间的非实质细胞,储存大量维生素A和脂质。此外,HSC可以调节门静脉压力并促进物质交换。HSC的数量占肝细胞的13%。此外,HSC是肝脏中主要的细胞外基质 (ECM) 生成细胞。值得注意的是,多项研究表明HSC 在肝纤维化中起着关键作用。当肝脏受到各种损伤时,静止的HSC会转变为活化的 HSC。活化的HSC特异性表达高水平的α-平滑肌肌动蛋白 (α-SMA)。这是通过ECM的强烈沉积来识别的,ECM会转化为肌成纤维细胞样细胞。因此,HSC被认为是肌成纤维细胞的主要前体细胞群(图2)。
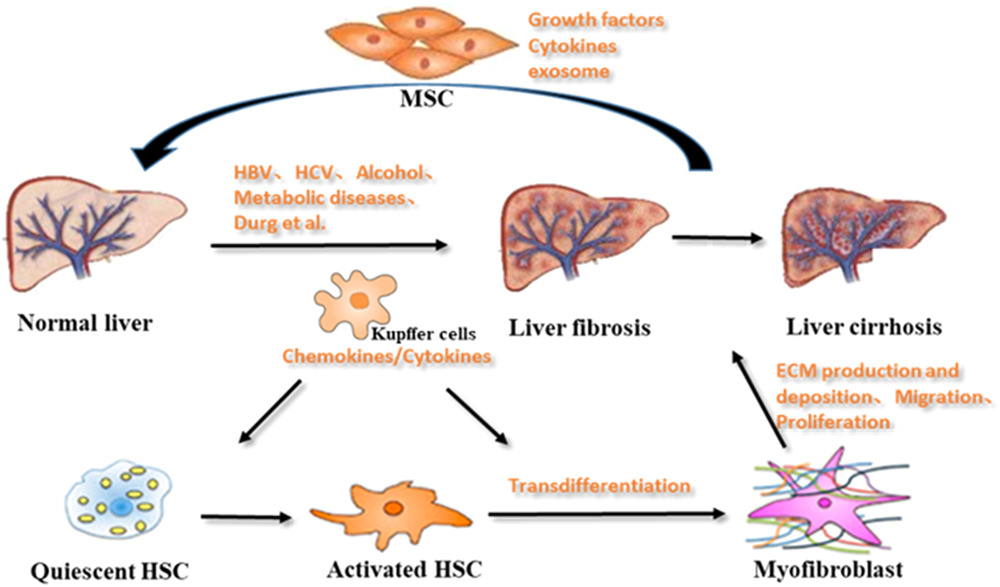
以前,肝纤维化被认为是不可逆转的。统计数据显示,肝硬化是全球成人死亡的第14位,影响着数亿人。直到20世纪90年代,研究才证实肝纤维化是可逆的。因此,采取有效的抗纤维化治疗措施,可以预防甚至逆转肝纤维化的病理过程就显得尤为重要。
间充质干细胞治疗肝损伤的作用机制
自1974年以来,当Friedenstein等人。首先分离和表征MSC,基于MSC的治疗已被证明是安全有效的。然而,许多科学家和临床研究人员希望提高MSCs在再生治疗中的成功率。间充质干细胞很容易分离并适合体外培养扩增。因此,MSC正被用作多种人类疾病的实验疗法。
此外,间充质干细胞同时发挥多种作用:通过释放细胞因子限制炎症;通过表达生长因子帮助愈合;通过分泌免疫调节蛋白改变宿主免疫反应;增强内源性修复细胞的反应;在某些组织中充当成熟的功能细胞,例如骨骼。目前正在临床研究MSCs在许多急性和慢性炎症性疾病中的作用。因此,由于其免疫调节和抗纤维化特性,间充质干细胞是减轻肝纤维化的一种新的有效疗法。
MSCs通过抑制炎症反应、抑制肝细胞凋亡、分泌多种可溶性因子、抑制氧化应激等,在肝损伤的治疗中发挥重要作用(图3)。
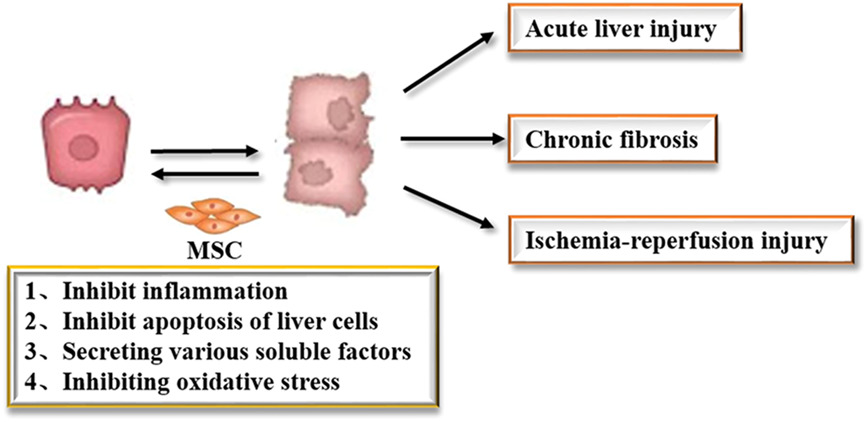
急性肝损伤的特点是起病急,病情进展快,可发展为急性肝功能衰竭。目前的治疗是原位肝移植。研究表明,MSC移植可以有效改善小鼠急性肝损伤的病情。此外,小鼠血清丙氨酸转氨酶 (ALT)、碱性磷酸酶、总胆红素和白蛋白水平可在细胞注射后4周恢复至正常水平。同时,MSCs可以定位于肝脏,对肝功能异常的治疗起到一定的作用。
慢性纤维化也是一种肝损伤。慢性肝炎导致HSCs活化,转化为肌成纤维细胞产生大量ECM。随着分解速度的加快,胶原纤维会逐渐沉积,导致肝纤维化的发生。经组织病理学观察证实,肝纤维化大鼠经门静脉移植MSCs后,肝纤维化程度可减轻,计算机断层扫描(CT)灌注扫描也显示血流动力学明显改善。在小鼠肝纤维化模型中,发现移植MSCs可显着降低I型胶原蛋白的表达,同时发现α-SMA阳性HSCs数量减少,表明其作用机制减少纤维化的方法可能是通过抑制HSC的活化。
肝移植引起的缺血再灌注损伤也是肝损伤的一种。这主要是由于一过性肝门静脉高压和肝窦内皮细胞的破坏,导致缺血时间延长,进而导致血液再灌注后严重的炎症反应。研究表明,在大鼠肝缺血再灌注模型中,移植MSCs大鼠2天后肝脏再生率明显高于对照组大鼠,血管内皮细胞表达水平明显高于对照组大鼠。与对照组相比,生长因子 (VEGF)、肿瘤坏死因子-α (TNF-α)、肝细胞生长因子 (HGF) 和其他再生相关蛋白也更高。
间充质干细胞治疗肝损伤的调控机制
越来越多的研究人员正在使用干细胞治疗多种肝脏疾病。大量研究证实,间充质干细胞移植可以改善肝功能,减轻肝纤维化,修复肝损伤,其治疗机制可能通过以下几个方面实现(图4)。
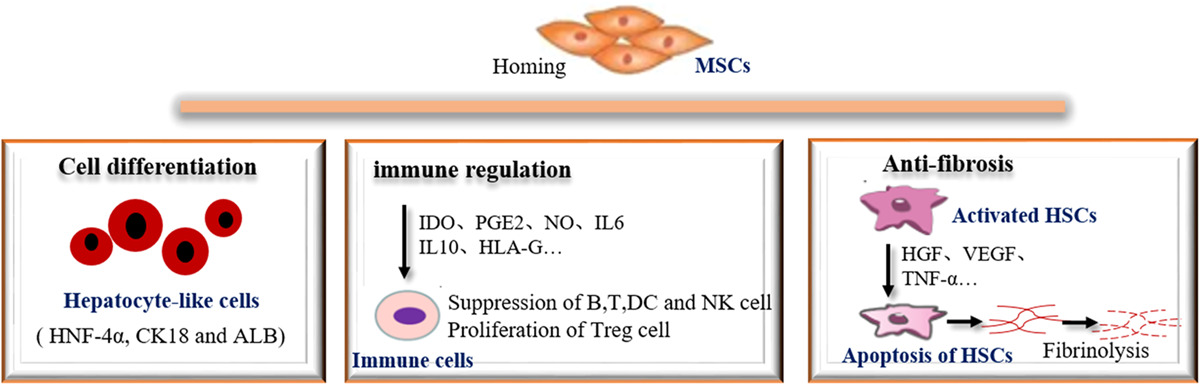
间充质干细胞的分化
MSCs可在体外诱导分化为肝细胞样细胞,并可表达肝细胞特异性标志物。
间充质干细胞的免疫调节
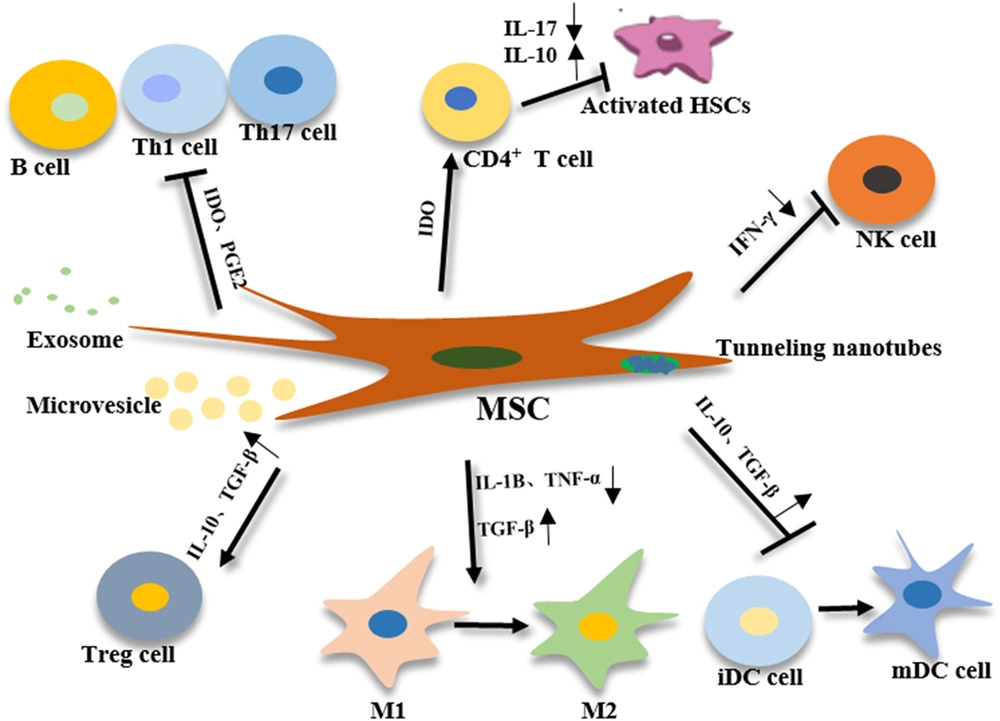
肝脏是人体非常重要的免疫器官,含有大量的免疫细胞。免疫反应与肝脏疾病的发展密切相关。MSCs可以通过分泌与先天性和适应性免疫系统细胞相互作用的可溶性因子来维持体内平衡,使它们能够参与多种肝病的治疗,而不受免疫排斥的影响(图5)。
间充质干细胞的抗纤维化作用
肝纤维化是肝脏结缔组织的异常增生。目前的病理机制是HSCs的激活和增殖以及α-SMA的产生。内源性或外源性MSCs可在各种因素的影响下定向迁移,穿透血管内皮细胞,并趋向于靶向组织并定位存活(图6)。
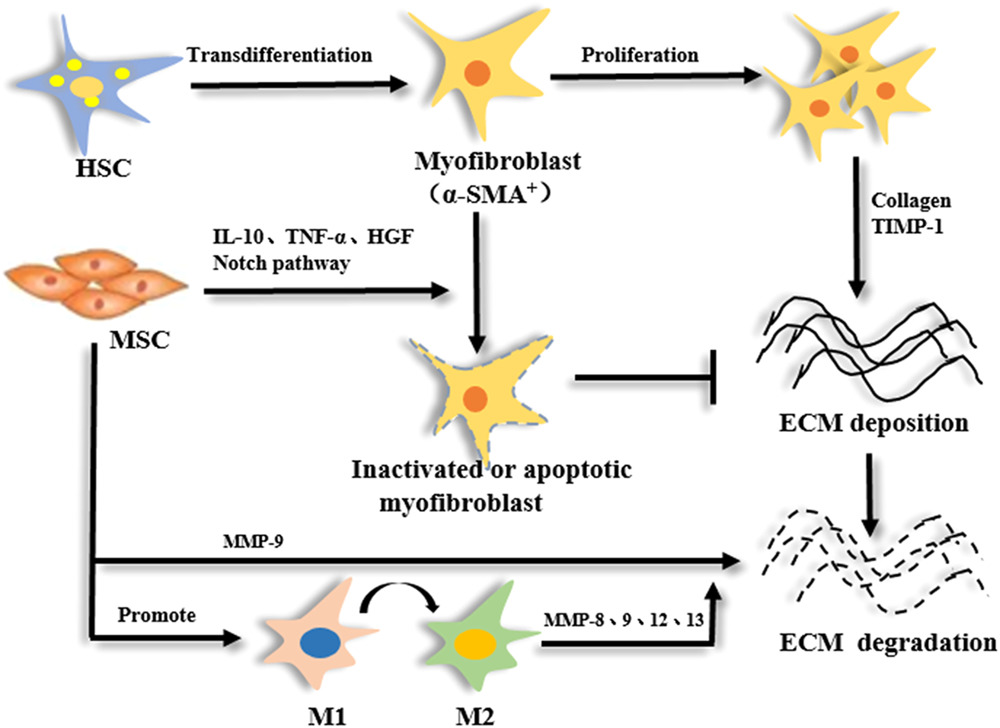
研究证实,MSCs针对肝脏受损区域,进而分泌可溶性因子,减少肝细胞凋亡,激活活化的HSCs,抑制其活化,重塑肝脏周围环境。在肝纤维化过程中,HSCs被激活增殖并转化为肌成纤维细胞,促进纤维化的发展。MSCs之所以能够抵抗纤维化,重要的原因在于MSCs能够抑制HSCs的活化和增殖。
肝移植后间充质干细胞的动力学
MSC进入体内后,不符合传统药物典型的分布和代谢模式。传统药物是被动分布的,而MSC具有向损伤部位趋化的特性,MSC在健康体和患病体中的分布是不同的。
通过门静脉或肝动脉将MSCs直接注射到肝血管中,可以改善细胞的输送和随后的肝脏移植。
间充质干细胞治疗肝损伤的临床进展
截至2022年11月,共有31个间充质干细胞治疗肝损伤疾病的临床项目完成临床试验注册(表2)。研究人员致力于开发新的方法来提高肝损伤动物模型在体内模拟MSCs的效率。但实际效果还需要通过临床试验来评估。终末期肝病(MELD)评分模型广泛用于实验研究和临床应用,以评估慢性肝病的严重程度。血清水平、总胆红素和其他指标用于评估肝病患者的预后恢复情况。
表2. MSC移植肝纤维化损伤的临床试验
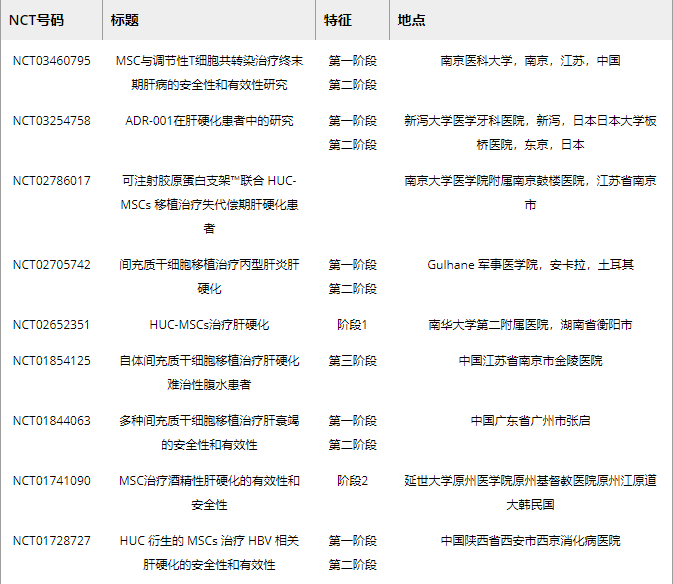

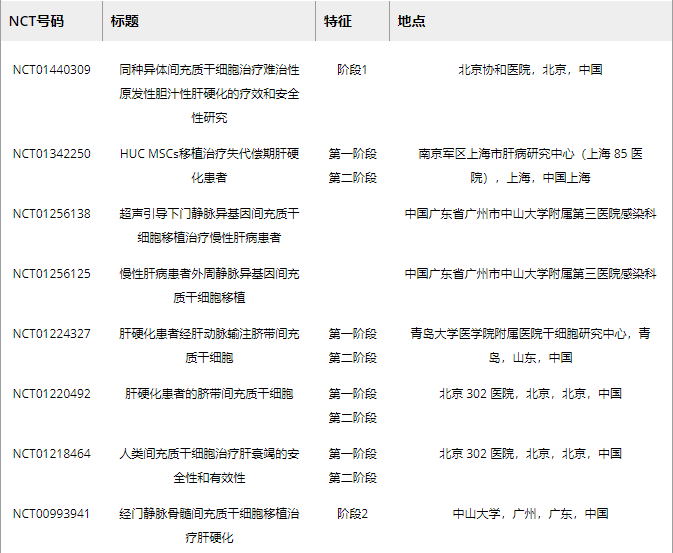

临床试验表明,在一项针对45名失代偿性肝硬化 (LC) 慢性乙型肝炎患者的研究中,与对照组相比,接受 UC-MSC输注治疗的患者腹水量显着减少。此外,UC-MSC治疗还显着改善了肝功能,表现为血清白蛋白水平升高、血清总胆红素水平降低以及MELD评分钠模型降低。
在Ming Shi等人进行的临床试验中,共有43名慢加急性肝衰竭 (ACLF) 患者与乙型肝炎病毒 (HBV) 感染相关。UC-MSC输注显着提高了ACLF患者的存活率,降低了MELD评分,提高了血清白蛋白、胆碱酯酶和凝血酶原活性,并增加了血小板计数。此外,在输注UC-MSC后,血清总胆红素和丙氨酸氨基转移酶水平显着降低。
从2010年到2013年,110名HBV相关的慢加急性肝衰竭患者参加了这项开放标签、非盲随机对照研究。实验组 ( n=56) 输注1.0–10.0×105细胞/kg同种异体骨髓来源的MSCs每周一次,持续4周,并随访24周。与对照组相比,同种异体骨髓来源的MSC治疗显着改善了临床实验室指标,包括血清总胆红素和MELD评分。
值得注意的是,为了更好地解释 MSCs 的安全性和有效性,还需要进一步研究,并应招募不同因素诱发的肝纤维化患者。尽管近年来MSC在治疗多种疾病方面具有诸多优势,但其临床应用仍需进一步深入研究。
此外,间充质干细胞移植还有一些问题需要解决,如MSC移植的合适时机、注射剂量、培养方案的优化等。然而,如何在体内提高MSCs的存活率、定植率和安全性,以及在此基础上如何发挥其效用,目前尚不清楚。因此,需要进一步的临床试验和多学科咨询来阐明这些。
结论
近年来,越来越多的学者将间充质干细胞移植用于治疗肝纤维化,并在体内外均显示出一定的抗纤维化作用。目前,为使间充质干细胞移植的疗效最大化,许多学者关注间充质干细胞与其他抗纤维化分子和药物的联合应用。间充质干细胞与其他抗肝纤维化方法联合可能产生更好的抗纤维化作用,是未来间充质干细胞治疗的发展方向。
目前,间充质干细胞移植的调控作用引发了对肝纤维化发生发展的广泛研究,但仍存在局限性。现有关于间充质干细胞与肝纤维化的研究多为体外和动物实验,尚需更多临床研究证实其疗效。此外,作为具有多向分化潜能的多能干细胞,MSCs移植也会在体内诱发不良反应,其治疗的副作用有待更深入的探讨。
因此,间充质干细胞应用于肝纤维化的潜在调控机制和分子靶点仍需进一步探索和研究,为间充质干细胞移植用于肝纤维化临床治疗提供合理有效的理论支持。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号