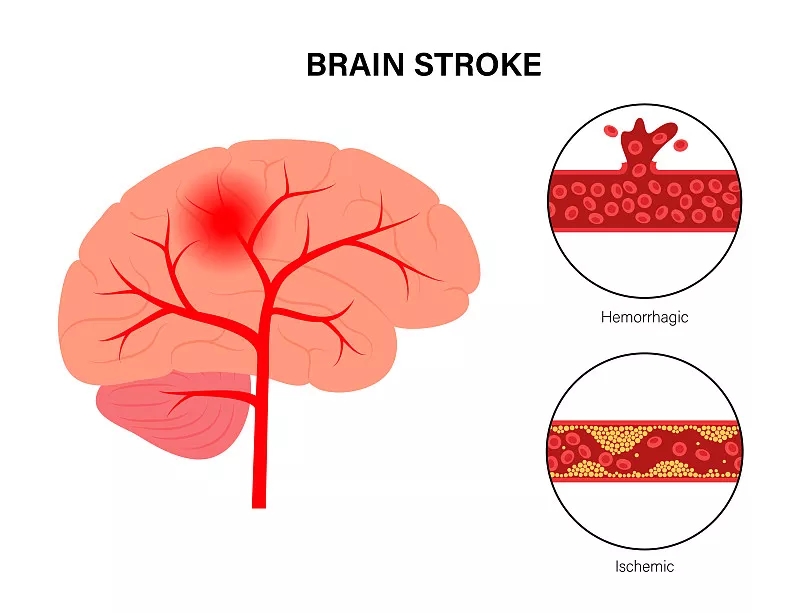
脑卒中是全球仅次于缺血性心脏病的第二大死因。缺血性脑卒中(ischemic stroke,IS)占所有脑卒中患者的87%,且其发病率仍在上升。由于局灶性脑缺血引起的急性神经功能缺损,给大量患者带来了不同程度的残疾负担。
目前,缺血性中风的治疗方案很少。静脉注射组织纤溶酶原激活剂(t-PA)可以使阻塞的血管再通。然而,这种治疗受到时间窗短(≤4.5小时)和继发性脑出血风险的限制。机械取栓(MT)可将治疗时间窗延长至24小时,但这种特殊手术只能在少数有资质的医院进行,需要经过严格的适应症和禁忌症筛选;只有少数患者可以接受MT治疗。此外,康复治疗只能带来有限的功能改善;仍有大量永久性残疾患者。因此,开发一种新的治疗缺血性脑卒中的药物势在必行。
间充质干细胞治疗缺血性脑卒中之前应该了解哪些问题
近20年来,干细胞疗法在不同的中枢神经系统疾病(如自身免疫性脑脊髓炎、脊髓损伤和脑卒中)中得到广泛研究。干细胞有多种类型,包括胚胎干细胞、神经干细胞、造血干细胞和间充质干细胞。
近年来,大量研究证明应用间充质干细胞可以减少脑梗死缺血后的面积,促进神经功能的恢复。间充质干细胞在IS中的治疗机制尚未完全明了,这可能与其神经元替代、神经发生、血管生成和抗炎作用有关。间充质干细胞产生的细胞外囊泡 (EV) 也可能在这一过程中发挥重要作用。大量的临床前研究证明了它的安全性。
本文旨在综述间充质干细胞治疗缺血性脑卒中的进展。间充质干细胞治疗缺血性脑卒中的机制涉及免疫调节、神经保护、血管生成和神经回路重建等。
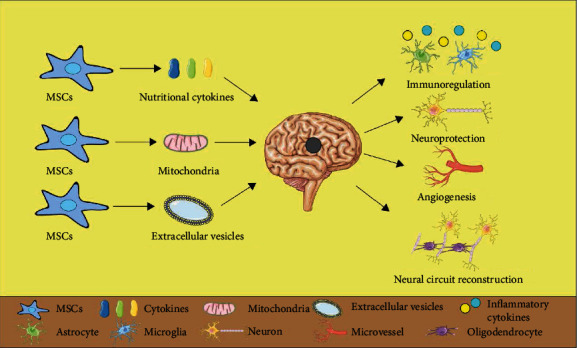
此外,营养细胞因子、线粒体和细胞外囊泡(EVs)可能是间充质干细胞治疗作用的主要介质。与单独移植 MSCs相比,移植间充质干细胞衍生的EVs (MSCs-EVs) 可提供更好的抗IS神经保护作用。间充质干细胞治疗可延长缺血性脑卒中的治疗时间窗,脑卒中后7天内早期给药可能是最佳治疗时机。递送常规包括脑室内、血管内、鼻内和腹膜内。这些数据支持了间充质干细胞治疗可能是一种有前途的IS治疗策略的观点。而新技术的应用将促进IS的间充质干细胞治疗。
间充质干细胞治疗缺血性脑卒中的机制
免疫调节:干细胞可通过与先天性和适应性的免疫细胞相互作用,同时调节系统免疫反应,帮助修复受损脑组织。它还能降低外周免疫抑制,减弱炎症反应,降低全身感染的发生率,并可能形成先天免疫类记忆反应,从而对急性炎症提供长期的持续保护。
神经保护:研究发现间充质干细胞移植后,MSCs直接释放或增加内源性神经营养因子的释放,如脑源性神经营养因子(BDNF)、神经生长因子(NGF)、神经胶质细胞源性神经营养因子(GDNF )和碱性成纤维细胞生长因子 (bFGF) 以达到神经保护作用。
血管生成:干细胞可通过分泌促血管生成因子(包括直接(VEGF、bFGF、HGF、Ang-1)和间接(TGF-β、IL-3、IL-6、IL-8)促血管生成因子),分化为内皮细胞或血管平滑肌细胞,并作为血管周细胞参与侧支重构。
神经回路重建:体内外研究均表明,干细胞可分化为内、中、外胚层系细胞,包括神经元、星形胶质细胞、少突胶质细胞、内皮细胞和血管平滑肌细胞等。这些成熟的细胞能够融合并替代受损细胞、构成神经血管单元,维持中枢神经系统微环境的稳态,并最终减少脑卒中后的神经功能缺陷。
线粒体转移:将健康的线粒体转移到受损细胞可能是间充质干细胞治疗缺血性中风的机制之一。
细胞外囊泡:间充质干细胞衍生的EVs(MSC-EVs)是由间充质干细胞分泌的球形细胞质成分,其中含有大量可溶性生物活性成分,如脂质、蛋白质、mRNA和微小RNA。它通过与靶细胞结合,将上述细胞成分和遗传基因转移到靶细胞中,从而调节靶细胞的活性和功能。作为 MSC 和受损细胞之间的关键信使,MSC-EV在MSC治疗IS中发挥着重要作用。
综上所述,免疫调节、神经保护、血管生成和神经回路重建可能是间充质干细胞治疗IS的主要机制,而营养细胞因子的分泌、线粒体的转移和细胞外囊泡的转移可能是其治疗IS的主要途径。 MSCs作用 (图1)。
该如何选择什么类似的间充质干细胞治疗缺血性脑卒中?
骨髓是第一个分离出MSC的组织。然而,骨髓中MSCs的产量很低。骨髓间充质干细胞(Bone marrow-derived MSCs,BM-MSCs)的增殖和分化潜能随年龄增长而下降,需要侵入性骨髓穿刺获得,这使得骨髓可能不是MSCs的最佳来源。此外,还从其他组织中分离出骨髓、MSCs,包括脂肪组织、胎盘、脐带和牙髓。
成人脂肪组织中存在大量功能性间充质干细胞。脂肪来源的 MSCs (AD-MSCs) 可以通过脂肪组织的胶原酶消化获得。与BM-MCS相比,AD-MSCs更容易获得和培养足够的自体移植物。人同种异体AD-MSC的免疫原性低于同种异体BM-MCS,而自体AD-MSC的免疫原性较低。由于其相当大的临床转化潜力,AD-MSCs 是除BM-MSCs之外IS中研究最多的MSCs。
研究表明,静脉注射AD-MSCs与注射BM-MSCs具有相同的疗效,AD-MSCs在减少梗死面积和改善神经功能方面更具优势。许多其他动物实验也证明,IS后AD-MSC移植具有免疫调节作用、神经保护作用、血管生成作用、神经回路重建作用。
牙髓提供了一种可获得的、无创的、高增殖潜力的间充质干细胞来源。研究表明,牙周膜干细胞 (PDLSCs) 比 DP-MSCs 更能促进脑缺血后神经功能的恢复。值得注意的是,最近的一项研究表明,人类 DP-MSCs 在体外分化为神经元后具有产生动作电位的能力。它们是否可以在 IS 动物模型中转化为功能性神经元仍有待探索。
从脐带血管周围组织和沃顿胶质(脐带血管周围的粘液结缔物质)中提取脐带来源的间充质干细胞 (UC-MSC)。与胎盘一样,脐带作为产后废物很容易获得,不存在伦理问题。多项研究比较了脐带来源的MSC、牙髓、骨髓和脂肪组织,发现脐带来源的MSC具有更强的增殖活性。研究表明,UC-MSCs和胎盘来源的MSCs(PL-MSCs)可以减轻大鼠脑缺血后的神经功能缺损,其潜在机制与上述相似。
除了BM-MSCs,来自脂肪、牙髓、脐带和胎盘的MSCs因其易于获得和强大的扩展能力而成为最有希望用于临床治疗的MSCs类型。未来的研究还需要阐明不同来源的MSCs作用机制的一致性和差异性,以及哪种MSCs在IS中获得最大疗效和最小不良反应,从而确定最适合临床应用的MSCs来源。
自体还是同种异体干细胞移植治疗缺血性脑卒中好?
虽然自体MSCs是最安全的,但同种异体MSCs更有优势。
首先,自体MSCs需要较长的培养和扩增时间,限制了其在IS急性期的应用,而异体MSCs可以更快地从冰箱中获得和扩增,从而避免了时间窗的延迟。
其次,IS患者通常服用抗血小板或抗凝药物,应用自体MSCs可能导致继发性出血。来自健康捐赠者的同种异体间充质干细胞没有这样的担忧。
第三,年龄是影响MSCs生理特性的因素。研究表明,老年供体的 MSCs 增殖和分化能力下降,分泌 BDNF、VEGF 和胰岛素样生长因子 (IGF) 等营养物质的能力也受到影响。因为IS患者通常年龄较大,因此从年轻健康供体获得的同种异体 MSCs 可能更有效。
间充质干细胞移植治疗缺血性脑卒中的移植途径有哪些?
实质内递送
脑内移植可有效治疗实验性缺血性中风。将MSCs直接注入脑实质,可使病灶区的MSCs数量最多,脑外副作用较少,可能带来最好的神经功能改善。对46篇文章的荟萃分析表明,不同的给药途径会影响MSCs治疗IS的疗效。脑内给药效果最好,其次是动脉内给药,最后是静脉内给药。
脑室内/鞘内给药
脑室内或鞘内注射 MSCs 可通过脑脊液扩散至中枢神经系统的各个部位。林等将MSCs注射到IS大鼠腰椎脊髓鞘内发现,与静脉注射相比,鞘内注射 MSCs 能有效迁移至梗死区,并能分化成神经元和星形胶质细胞,促进脑梗死大鼠运动功能的改善。
静脉给药
静脉注射的优点是避免了颅内侵犯,创伤小,操作简单易行。许多MSCs治疗IS的临床前试验均采用静脉注射的方式取得了良好的效果,包括减少梗死体积和改善神经功能等。
动脉内分娩
动脉内注射是血管内给药的另一种方法;大多数研究采用颈内动脉注射。动脉内注射既保留了微创血管内给药的优点,又可以绕过肺循环,提高病灶内MSCs的浓度。临床试验已经证明动脉内注射MSCs治疗IS患者的有效性和安全性,因此动脉内注射可能是另一种合适的血管内途径。
腹腔分娩
腹腔注射是一种较少使用的MSC管理方式。这种给药方式会导致大量的MSCs聚集在腹腔内,而迁移到其他器官的MSCs数量很少。
鼻内给药
鼻内途径是一种新的干细胞移植途径。经鼻移植的MSCs可以绕过鼻粘膜处的血脑屏障,然后通过嗅觉感觉神经进入大脑或通过脑脊液进一步转移到颅内其他区域。洲等人报道经鼻给药的MSCs在分娩后6小时到达梗死周围区域,经鼻移植的MSCs可以缩小梗死体积,促进神经功能的恢复。
综上所述,目前MSCs治疗IS的研究中,脑实质内给药、静脉内给药和动脉内给药是应用最为广泛的三种方式,不同的给药方式各有优缺点。表格1)。血管内注射可能是MSC给药的合适途径。鼻腔给药作为一种新的干细胞移植方式,具有巨大的临床应用潜力。未来的研究需要评估和比较不同给药方式的安全性和有效性,以选择最合适的给药方式。
表格1:不同MSC移植方法的优缺点。
| 航线 | 优点 | 缺点 | 参考 |
|---|---|---|---|
| 实质内 | 最高归巢率;低脑外副作用 | 侵袭性强;额外的脑组织损伤 | [27 , 124] |
| 脑室内/鞘内 | 允许迁移到 CNS 的不同部分;高归巢率 | 侵入性 | [126] |
| 静脉 | 低侵入性;操作简单 | 外周组织停滞;肺栓塞 | [128 , 129] |
| 动脉内 | 低侵入性;相当大的归巢率 | 微血管闭塞 | [130 , 132] |
| 腹膜内 | 低侵入性;高存活率 | 归巢率低 | [116 , 134] |
| 鼻内 | 无创性;操作简单;重复给药 | 缺乏临床试验证据 | [136–138] |
间充质干细胞移植治疗缺血性脑卒中的移植时机
由于不同研究的给药方式、剂量、神经功能评价等不同,无法客观得出最佳给药时间。一项涉及141篇文章的荟萃分析将这些研究的给药时间分为四组:0-6小时、12-24小时、2-7天和>7天。结果发现,与12-24小时组和>7天组相比,2-7天组的综合神经功能评分明显改善。
此外,0-6小时和2-7天之间没有显着差异,这表明IS后0-6小时和2-7天可能是给药的最佳时间。一方面,IS后早期,局部脑组织缺氧缺能,炎症反应强烈,导致MSCs存活率低。因此,IS后2-7天给药可能会增加MSCs的存活率,使MSCs发挥更大的作用。
另一方面,0-6小时给予MSCs诱导的神经功能显着改善可能与及时抢救缺血半暗带神经元、早期干预炎症细胞、激活炎症级联反应有关。此外,该研究还发现,与其他组相比,0-6 小时给药导致感觉运动结果的最显着改善。因此,脑卒中后7天内及早给药可能是治疗的最佳时机。
间充质干细胞移植治疗缺血性脑卒中的细胞剂量越多越好越好吗?
MSC的剂量越大,获益越大吗?
林等在小鼠MCAO后24小时静脉内注射1×106和4×106人UC-MSCs,发现高剂量的人UC-MSCs不会导致更显着的梗塞面积减少。作者认为,这可能是由于静脉注射大剂量的MSCs 后,大部分MSCs残留在外周组织中,使得最终到达中枢神经系统的MSCs数量没有预期的多。
间充质干细胞移植治疗缺血性脑卒中的临床试验
大量临床前数据证明了MSCs治疗IS的可行性,干细胞治疗的临床应用也值得期待。多项临床试验证明了MSCs治疗IS的有效性和安全性。最早的临床试验仅包括30名受试者,其中5名受试者在急性中风后5-7周接受了1×108个MSCs。在1年的观察期内,这5名患者均未报告不良事件。且这5例患者的巴塞尔指数 (BI) 均有明显改善,提示神经功能有一定改善。
李等招募了85名严重缺血性脑卒中患者。在5年随访期间,MSC治疗组累积生存率更高,改良Rankin量表(mRS)评分较低(0-3)的患者更多,且无不良反应。
此外,Jaillard等人进行的一项随机对照试验。研究表明,尽管静脉注射自体间充质干细胞并未改善BI、mRS和2年后美国国立卫生研究院卒中量表 (NIHSS),但促进了运动功能评分的改善。

近年来,越来越多不同的临床试验显示出多元化临床转化的可能性。Levy等人进行的I/II期临床试验。首次证明单次静脉注射同种异体BM-MSC是安全有效的。随访期间出现的15种严重不良反应均与干细胞治疗无关。此外,在第2阶段静脉注射150万个细胞/千克同种异体MSC显示BI评分和NIHSS评分有显着改善。
邓等进行了II期临床试验,首次评估鞘内输注同种异体BM-MSCs治疗IS的安全性和有效性。59名受试者每周接受四次同种异体BM-MSC鞘内输注(1×106细胞/公斤体重),主要是评估治疗90天后的mRS评分和不良事件的发生情况。该项目仍在进行中。一些文献也报道了修饰的MSCs治疗IS的临床试验。

斯坦伯格等人将转染Notch-1基因的BM-MSCsSB623细胞移植到18例慢性中风患者脑内;结果显示,经过24个月的治疗后,欧洲卒中量表 (ESS) 评分、NIHSS评分、Fugl-Meyer (FM) 总分和FM运动量表评分显着改善。有一张间充质干细胞治疗缺血性脑卒中患者的临床试验表(表3)。
| Type of trial | Stroke type | Sample sizes | Cell type | Dose/single (S) or multiple (M) | Route | Time of adm. from stroke onset | Follow-up | Result | Reference |
|---|---|---|---|---|---|---|---|---|---|
| RCT | Acute IS | 30 | BM-MSCs/autologous | 5 × 107/M | IV | 4-5 weeks 7-9 weeks | 1 year | Significant improvement in BI. No significant difference in NIHSS and MRI scan | [200] |
| RCT | Acute IS | 85 | BM-MSCs/autologous | 5 × 107/M | IV | 5 weeks 7 weeks | 5 years | No significant side effects. Patients with mRS 0–3 significant increased | [201] |
| OL-PT | Chronic IS | 12 | BM-MSCs/autologous | 0.6–1.6 × 108/S | IV | 36–133 days | 1 year | No side effects. Decreasing of infarct volume by>20% at 1 week | [210] |
| OL-PT | Subacute IS | 11 | BM-MSCs/autologous | 85 × 106/S | IV | 7–30 days | 6 months | No side effects. Improvement in NIHSS, BI, and mRS | [211] |
| SB-CT | Acute IS | 20 | BM-MNCs/autologous | 1.59 × 108/S | IA | 5–9 days | 180 days | No side effects. No significant differences in neurological function | [212] |
| OL-PT | Chronic IS | 36 | BM-MSCs/allogeneic | 1.5 × 106/S | IV | >60 days | 12 months | No side effects. Significant improvement in BI and NIHSS | [213] |
| OL-PT | Chronic IS | 18 | SB623 cells/allogeneic | 2.5 × 106/S 5.0 × 106/S 10 × 106/S | IC | >60 days | 24 months | All experienced at least 1 treatment-emergent adverse event. Significant improvements in NIHSS F-M and ESS | [205] |
| RCT | Subacute IS | 31 | BM-MNCs/autologous | 1.0 × 106/S 3.0 × 106/S | IV | <2 weeks | 2 years | No significant improvements in NIHSS, BI, and mRs. Significant improvements in motor function | [202] |
| OL-PT | Chronic IS | 12 | BM-MNCs/autologous | Not provided | IV | 3-24 months | 4 years | No side effects. Significant improvements in mBI at 156 and 208 weeks | [214] |
讨论
免疫调节、神经保护、血管生成和神经回路重建是间充质干细胞治疗IS的主要机制。除旁分泌外,线粒体转移或细胞外囊泡转移也可能是MSCs发挥作用的主要途径,MSC-EVs可能是MSCs治疗IS的有效替代策略。
间充质干细胞治疗延长了治疗缺血性脑卒中的时间窗,脑卒中后7天内早期给药可能是治疗的最佳时机。虽然应用血管内注射MSCs可能是IS的适当治疗方法,但可能需要更多的努力来确定潜在的不良反应。通过鼻内途径递送MSCs也可能是一种很有前途的MSCs移植方式。
此外,需要研究用MSCs治疗的最佳剂量。此外,有许多不同的治疗策略可以优化MSCs的疗效;研究人员应该在这方面开展临床试验,以期在未来实现更好的临床转化。
未来发展方向
间充质干细胞干预脑卒中逐渐被国家重视
近几年来,国内外相继发表的研究成果不断肯定了间充质干细胞在干预脑卒中领域的潜力。间充质干细胞用于缺血性脑卒中也吸引了大量的研究学者。仅仅在中国知网数据库中粗略的检索就能检索到191项关于间充质干细胞用于缺血性脑卒中的研究,而这些研究也只是众多数据库中的冰山一角。
在国家层面,也已将干细胞干预脑卒中项目纳入了“干细胞及转化研究”重点专项计划,并获得了由国家财政经费拨款的大力支持。同时,由国家药品监督管理局药品审批中心数据显示,其中用于缺血性脑卒中的间充质干细胞新药已经获得了临床试验默示许可(受理号:JXSL1900126)。
结论
综上所述,间充质干细胞移植为缺血性脑卒中的治疗提供了希望。进一步研究其作用机制,优化其治疗策略,将为间充质干细胞治疗的临床转化打下坚实的基础。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。
版权说明:本文来自杭吉干细胞科技内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在网站后台下方留言获取。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号