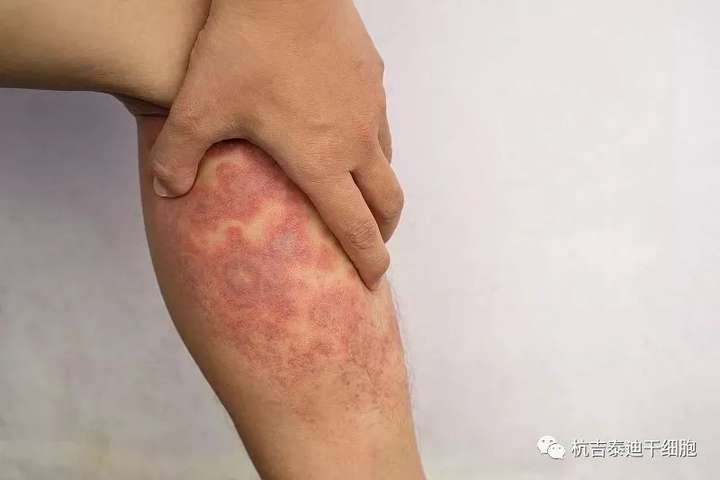
特应性皮炎 (AD) 是一种炎症性疾病,其特征是极度瘙痒和皮肤损伤,影响全世界的人类。AD影响全世界大约15%–20%的人类,它正在成为一种更常见的诊断疾病。AD治疗通常涉及药物干预,如糖皮质激素、过敏原特异性免疫疗法、抗组胺药或Janus激酶抑制剂,但这些治疗只能提供暂时的缓解并表现出各种副作用。
间充质干细胞 (MSC) 是多能干细胞,能够分化成多种细胞谱系,包括骨细胞、脂肪细胞和软骨细胞。MSCs可分离自骨髓、脂肪组织、脐带血等多种组织来源。重要的是,间充质干细胞显示出独特的免疫抑制和免疫耐受特性,这使得异基因间充质干细胞移植成为理想的细胞疗法。
近年来的研究表明,间充质干细胞可作为免疫相关疾病(如哮喘、狼疮和AD)的潜在替代疗法。在本文中,我们将回顾MSCs和MSCs衍生的条件培养基和外泌体治疗AD的最新进展。

特应性皮炎的发病机制
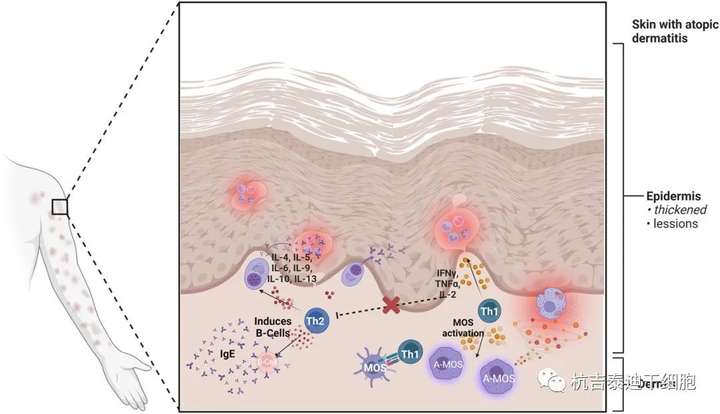
AD的发病机制是多因素的,包括遗传易感性、免疫致病因素和表皮屏障缺陷。虽然AD的免疫发病机制很复杂,但已知辅助性T (Th) 细胞(由Th1和Th2细胞组成)在AD发病机制中发挥着核心作用(图2)。
Th1细胞在细胞介导的炎症反应中分泌干扰素γ (IFN-γ)、肿瘤坏死因子β (TNF-β) 和白细胞介素 (IL)-2,以激活细胞毒性、炎症和迟发性超敏反应并促进巨噬细胞发育。相反,Th2细胞通常分泌IL-4、IL-5、IL-6、IL-9、IL-10和IL-13细胞因子,以诱导B细胞产生抗体,如IgE,用于过敏反应。Th1和Th2细胞都与AD发病机制有关,并且分泌的细胞因子是复杂的相互关联的。Th2细胞主要浸润急性AD病变,而Th1细胞主要浸润慢性AD病变。Th1细胞产生的IFN-γ可抑制Th2细胞活化,导致IgE合成减少。
因此,细胞因子表达的双相特征通常发生在AD期间,Th2细胞激活在早期急性期优于Th1细胞,反之亦然在后期慢性期。
干细胞治疗特应性皮炎的作用机制
抑制皮肤炎症
干细胞可通过减少全身炎症减轻体内特应性皮炎症状,间充质干细胞(MSCs)调节Th1/Th2免疫平衡,上调Treg细胞。经MSCs输注的特应性皮炎皮损明显改善,皮损中炎性细胞浸润数量明显减少,耳部引流淋巴结CD4+CD25+叉状头螺旋转录因子(Foxp)3+调节性T细胞(Treg)数量明显增加,IFN-γ/IL-4比例升高。

修复受损的皮肤屏障
另一学者将脂肪来源的MSCs外泌体注射到特应性皮炎小鼠体内,而接受地塞米松的特应性皮炎小鼠作为对照组,共进行12次移植,结果测定:MSCs外泌体诱导表皮神经酰胺和二氢神经酰胺的产生,显著减少了表皮失水,增强角质层(SC)水合作用。经干细胞治疗后,模型小鼠皮肤病变的深RNA测序分析表明,MSCs外泌体恢复了皮肤屏障、脂质代谢、细胞周期和炎症反应的基因的表达。
干细胞可通过旁分泌的方式,促进神经酰胺的从头合成有效地恢复特应性皮炎中的表皮屏障功能,修复由慢性炎症或自身免疫性疾病引起的皮损。
间充质干细胞治疗特应性皮炎的临床案例
近年来,MSC的安全性和有效性也在人体临床试验中得到了评估。
2017年《Stem Cells》杂志中报道了,一项双盲、随机及对照的Ⅱ期临床试验进一步证明了其疗效,在3个月的时间里,hUCB-MSCs被皮下注射到34名患有中度至重度AD的成年人中。随机选择患者接受2.5×107个细胞/kg 的低剂量或5.0×107个高剂量的 hUCB-MSC细胞/公斤。使用湿疹面积和严重程度指数 (EASI) 评分、研究者总体评估 (IGA) 评分和特应性皮炎严重程度评分 (SCORAD) 评分来评估治疗效果。
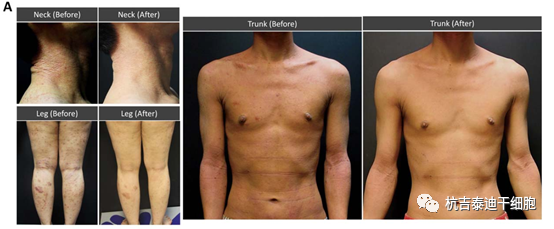
该研究表明,单次剂量的hUCB-MSCs导致AD表现的剂量依赖性改善,55%的患者在EASI评分、IGA评分和 SCORAD 评分中分别降低了50%、33%和50% , 在高剂量治疗组。特别是,高剂量 hUCB-MSC治疗使瘙痒评分降低了58%,并且在研究期间没有发生严重的不良事件。

2021年,Shin等人报道了同种异体骨髓来源的MSCs (1.0×106细胞/公斤)以2周的间隔静脉注射3次给五名常规治疗难治的中度至重度AD成年患者。

然后,他们使用EASI评估了临床反应,结果显示在16周时有显着改善,80% (4/5) 的患者在接受一两次治疗后达到EASI-50。在平均38周的患者中观察到长期疗效且无严重副作用,并且三种细胞因子CCL-17、IL-13和IL-22在五名参与者的终点显着降低。
此外,hUCB-MSCs来源的无细胞条件培养基也被研究用于治疗人类AD,结果表明,将条件培养基应用于轻度AD患者的病灶4周后,皮肤屏障得到加强增加Corneometer的水平并降低经表皮水分流失的值。进一步的研究表明,条件培养基可能通过激活B细胞抑制IgE分泌来发挥其抗炎作用。

结论
特应性皮炎已成为许多物种中极为棘手的疾病,需要安全有效的治疗方法。间充质干细胞的特应性皮炎疗法近年来得到了广泛研究,因为它们显示出独特的免疫抑制和免疫耐受特征,这使得注射同种异体MSCs成为一种有前途的细胞疗法。
在人体临床试验中,在使用同种异体hUCB-MSCs、骨髓来源的MSCs和hUCB-MSCs的无细胞条件培养基的治疗中,已经观察到AD状况的有效改善。
近年来,人们越来越关注间充质干细胞外泌体治疗各种疾病。在特应性皮炎治疗中研究间充质干细胞外泌体才刚刚开始,初步结果表明,间充质干细胞外泌体减轻了小鼠和人类的AD病变。然而,在间充质干细胞的疗法成为伴侣动物和人类特应性皮炎的批准标准治疗选择之前,仍需要更多研究来评估MSCs或间充质干细胞外泌体的最佳剂量、理想的给药途径以及制备和移植GMP的标准方法。
说明:本文,仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议,如有版权等疑问,请随时联系我。
参考资料:Najera, J, Hao, J. Recent advance in mesenchymal stem cells therapy for atopic dermatitis. J Cell Biochem. 2022; 1- 7. doi:10.1002/jcb.30365




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号