间充质干细胞 (MSC) 在1960年代后期首次被定义为源自骨髓 (BM)的成纤维细胞样细胞,具有高度分化和自我更新的多能性。后来,卡普兰等人等发现骨髓来源的成纤维细胞样细胞也具有成骨和软骨形成能力,并于1991年将这些细胞命名为“MSCs”。
然后,已发现MSC可以分化为其他几种间充质组织,例如肌细胞和脂肪细胞. 进一步的研究表明, MSC可以在体外分化成不同的谱系,包括上皮细胞、神经元细胞、星形胶质细胞形态、内皮细胞和平滑肌细胞,这取决于共培养细胞类型的特定条件。
同时,Dazzi等人和Taechangam等人表明多能能力、支持BM中的造血功能及其免疫调节作用积极赋予 MSCs治疗作为一种有前途的治疗策略。
许多研究报道,可以从脂肪组织中分离出MSCs。已经表明,具有多能性的脂肪MSCs (AMSCs) 会产生脂肪细胞、神经细胞、软骨细胞、肌细胞和成骨细胞谱系。其他报道发现,源自AMSCs的外泌体可以减轻炎症反应,促进伤口愈合,抑制骨关节炎软骨退化。MSCs恢复粘膜免疫力并恢复老年人的粘膜免疫衰老。此外,将AMSCs重编程为低免疫原性的胰岛β细胞在治疗犬糖尿病方面取得了理想的治疗效果。
间充质干细胞来源
间充质干细胞来源也可以从新生儿组织中分离出来,包括人脐带血(HUCB-MSCs)、脐带MSCs(HUC-MSCs)、羊水(HAF-MSCs)、胎盘MSCs(HP-MSCs)和羊膜(HAM -MSCs) ,已用于治疗动物模型和脑出血(ICH)患者的神经功能缺损。最近,一项临床试验的报告发现,对于中度和重度冠状病毒病2019(COVID-19)患者,静脉输注HUC-MSCs是安全且耐受性良好的,这可能被认为是针对潜在异常的有前途的治疗方法。间充质干细胞具有免疫调节和抗炎特性的HUC-MSC移植出现在免疫和炎症性疾病中,被认为是未来治疗利用的前景。
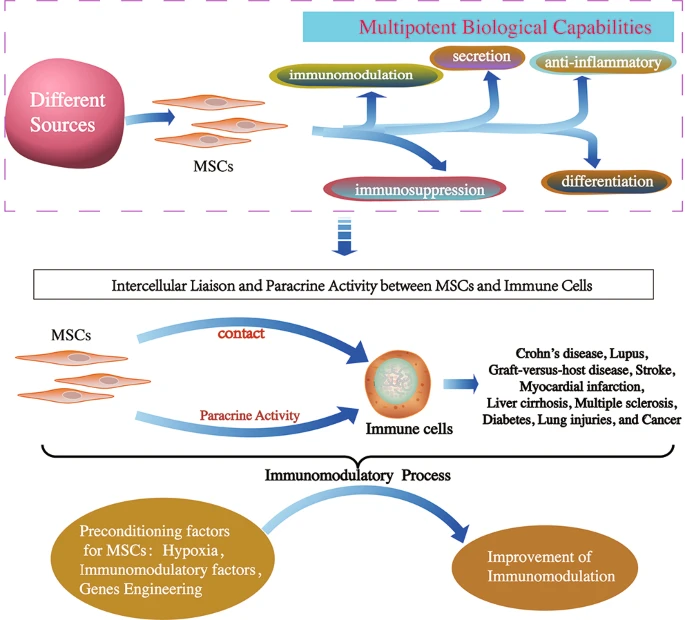
MSCs通过免疫抑制、抗细胞凋亡、抗炎、抗纤维化、促血管生成、抗肿瘤生成、神经保护、抗菌和化学吸引作用等机制在修复受损组织中发挥关键作用。这些独特的特性赋予MSCs作为再生医学中有前途的候选者,并在炎症性疾病和癌症中具有吸收治疗潜力。
最初,MSCs主要用作再生医学组织修复的有前途的细胞疗法。已经表明,它们已被批准用于自身免疫性疾病的临床研究,包括克罗恩病、狼疮和移植物抗宿主病 (GVHD) 。同样,在临床前和人类转化研究中,MSC已被研究用于治疗不同疾病的潜力,包括中风、心肌梗塞、肝硬化、多发性硬化症、糖尿病、肺损伤和癌症。
此外,作为潜在治疗方法的MSCs除了具有多效性外还具有免疫调节功能,已针对各种免疫疾病进行了研究。MSCs通过直接的细胞间接触及其与先天性和适应性免疫系统中免疫细胞的分泌能力,强有力地发挥其免疫调节作用。到目前为止,跨组织来源和物种的MSCs的免疫调节功能已经得到很好的复制和临床相关。在这篇综述中,我们总结了最近MSCs在不同疾病中的免疫调节特性,并讨论了各种疾病的潜在治疗靶点。
间充质干细胞的免疫调节
最近的研究结果表明,MSCs通过特殊的细胞因子非依赖性机制进行与单核细胞和调节性T细胞 (Treg) 相关的免疫调节活性。AMSCs显示出比BMSCs更多的潜在免疫调节作用,表明AMSCs可以作为免疫调节疗法的更好替代品。相比之下,HUC-MSCs对体内同种异体免疫风险的反应最小,将HUC-MSCs视为合适的治疗候选者。
一些报道还发现,异种人MSCs有可能在小鼠肿瘤疾病、绵羊胫骨缺损、猪骨软骨重建和犬科动物软骨再生中表现出积极的能力。具有较低弱免疫原性的异种人MSCs在临床前和临床研究中具有治疗潜力。因此,我们总结了原始和修饰的MSCs的免疫调节作用,并回顾了目前对其免疫调节方面的理解。
通过细胞间联络的免疫调节
许多临床前研究报告称,MSCs的给药通过与由T细胞、B细胞、中性粒细胞、单核细胞、巨噬细胞、自然杀伤 (NK) 细胞和树突状细胞 (DC) 组成的免疫细胞进行交流,参与先天性和适应性免疫反应),通过细胞间联络和旁分泌作用发挥免疫调节作用(图1)。
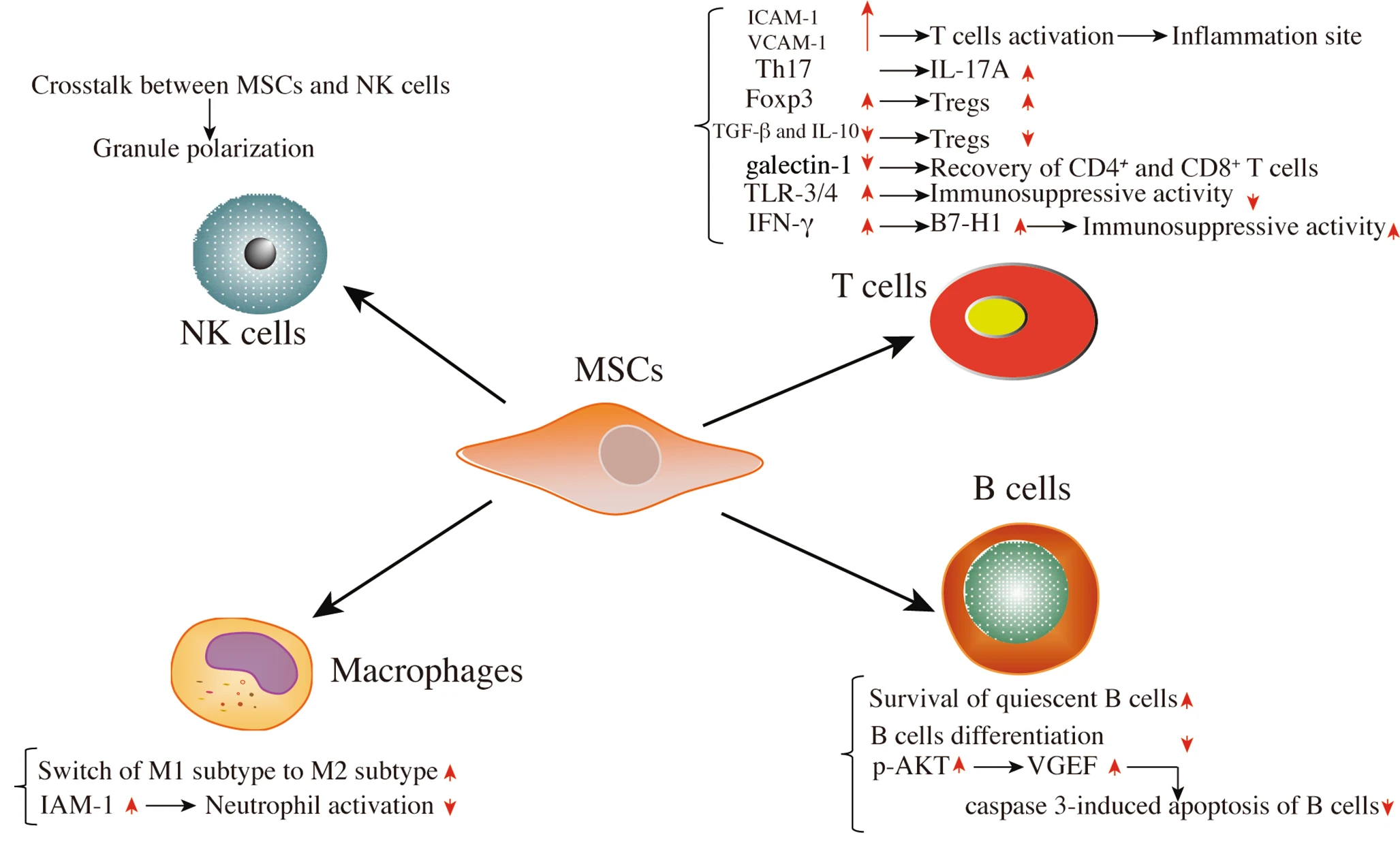
MSCs主要通过与T细胞、B细胞、自然杀伤(NK)细胞、巨噬细胞等免疫细胞的相互作用发挥免疫调节作用,细胞间接触与蛋白表达的调节有关。
适应性免疫中的细胞间联络
如体外实验所示,BMSCs在物理上阻碍了幼稚和记忆T细胞反应以非同源方式与抗原呈递细胞 (APC) 结合。该功能通过血管细胞粘附分子-1 (VCAM-1) 和细胞间粘附分子-1 (ICAM-1) 的分泌增强表现出来,有利于T细胞活化和白细胞向炎症部位募集,发挥关键作用在免疫抑制能力中的作用。
先天免疫中的细胞间联络
除了适应性免疫系统外,MSCs还基于细胞间联络机制作用于先天免疫系统。
MSC发挥免疫调节活性的各种已知机制如图1所示 。然而,它需要大量的临床前研究才能转化为临床研究。
通过旁分泌活动进行免疫调节
MSC的分泌蛋白组
MSC 还通过释放分泌蛋白组来发挥或传递显示其免疫调节功能的调节信息。这种源自具有免疫调节功能的 MSC 的分泌蛋白组由一系列细胞因子、生长因子、趋化因子和细胞外囊泡 (MSCs-EV) 组成,它们与先天和适应性系统的免疫细胞相互作用,调节免疫和癌细胞功能。
根据它们的大小和来源,MSCs-EVs中封装的旁分泌分子通常分为来自多泡内体的外泌体(30-120nm)、来自质膜的微泡(MV)(100-1000 nm)和凋亡小体。MSC-EV与免疫细胞之间的相互作用可被视为炎症、感染和自身免疫性疾病的理想治疗前景。尽管MSC-EV在免疫调节功能方面与母体MSC相似,但MSC的旁分泌功能取决于适当的培养条件。因此,了解MSC的旁分泌功能以提高其免疫调节作用至关重要(表1)。
表1:MSCs的分泌蛋白组
| cytokines | chemokines | Growth factors | Other factors |
|---|---|---|---|
| IFN-γ, TGF-β, TNF-α, LIF, MIF, OSM, G-CSF, M-CSF, GM-CSF FLT3LG, SCF, Thrombopoietin, TSG-6, IL-1α, IL-1β, IL-2, IL-3, IL-6~8, IL-10-13, IL-16, | CCL1, CCL2, CCL5, CCL8, CCL11, CCL15, CCL16, CCL18, CCL22~24, CCL26, CXCL1-3, CXCL5, CXCL6, CXCL8, CXCL11~13, CX3CL1, XCL1 | BDGF, NGF, GDNF, PIGF, PDGF, VEGF, HGF, EGF, IGF-1, FGF-2, FGF-4, FGF-7, FGF-9, BMP-7 | phospholipids, Adrenomedullin, Adiponectin, Osteoprotegerin, miRNAs, mRNAs, long non-coding RNAs, CXCR3, PGE2, PAI-1, MMP1, MMP3, MMP9, MMP10, MMP13, TIMP-1~4, Leptin, IGFBP-1~4 |
间充质干细胞在适应性免疫系统中的旁分泌功能
MSCs根据其旁分泌分泌对适应性免疫系统发挥免疫调节特性。
间充质干细胞在先天免疫系统中的旁分泌功能
MSCs通过急性抑制IL-2介导的静息NK细胞增殖与NK细胞交流,并改善先天免疫系统的NK功能。
由细胞因子、生长因子和趋化因子组成的源自MSC的不同分泌蛋白组参与了适应性和先天性免疫系统以发挥免疫调节作用(图2)。
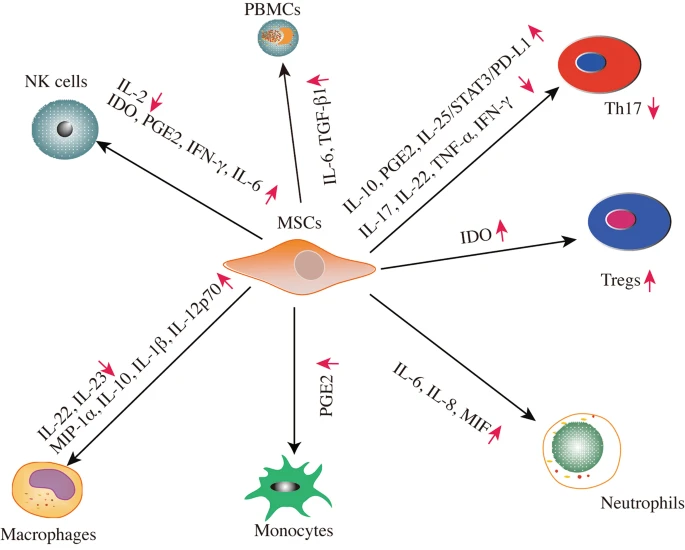
MSC通过旁分泌活动与免疫细胞(如T细胞、自然杀伤 (NK) 细胞、巨噬细胞、单核细胞、PBMC和中性粒细胞)相互作用,发挥免疫调节作用。MSCs的分泌蛋白组分泌一系列细胞因子、生长因子和趋化因子来发挥其免疫调节功能。
通过修饰的间充质干细胞提高免疫调节能力和治疗效果
越来越多的证据表明,预处理的MSCs可以提高它们的旁分泌效力和治疗能力。已经表明,用缺氧、生长因子、热休克蛋白 (Hsp)、LPS、药物制剂、化学制剂、血清剥夺或炎症刺激预处理的MSCs具有通过增加细胞保护基因和修复因子的分泌。因此,预处理条件可以在体外培养中调节MSCs的分泌蛋白。分析分泌蛋白组对各种生物过程的影响至关重要,包括免疫调节、血管生成、抗纤维化、神经发生、伤口愈合、组织修复以及组织修复和再生的抗肿瘤。
间充质干细胞的免疫调节机制治疗疾病的临床试验
已经进行了39项研究来调查临床试验中MSC的免疫调节作用。他们关注的疾病是感染、糖尿病、膝骨关节炎、复发缓解型多发性硬化症(RRMS)、克罗恩病等,代表了临床上最常见的免疫系统疾病(表2)。
最近的I/IIa期试验(标识符:https ://clinicaltrials.gov/ct2/show/NCT02351011) 对12名晚期Kellgren-Lawrence膝骨关节炎患者每人使用了5000万剂量的BMSC。结果表明,施用源自髂后上棘BM的自体 BMSCs可提高生活质量,关节内注射安全,无严重不良事件,并有助于改善滑膜炎症和疼痛。
同样,进行的II/III期研究(临床试验编号:(UMIN-CTR编号iii:UMIN000006719)表明BMSC移植提高了 25名急性GVHD(类固醇难治性III级或IV级)患者的总体存活率,没有观察到的不良事件。
在一项开放标签IIa期研究(临床试验编号:NCT00395200)中,将剂量为1.6×106个细胞/kg体重的自体 BMSC安全地给予继发性进行性多发性硬化症 (SPMS) 患者,并改善结构、功能和生理学证明了神经保护作用。
在针对34名患有中度至重度 (AD) 特应性皮炎成年患者的I/IIa期研究中,皮下输注高剂量HUC-MSC(5.0 ×107个细胞)在治疗上改善了疾病特征,表明严重程度评分显着降低,并且湿疹面积、特应性皮炎严重程度指数、瘙痒评分、血清IgE水平和血嗜酸性粒细胞数。
一项与连续12名难治性瘘管克罗恩病门诊患者进行自体BMSCs连续瘘管内给药相关的初步研究表明,局部BMSCs治疗是可行的、安全的,并且通过调节粘膜T细胞凋亡率和7例持续完全闭合的患者对这种疾病有益在12名患者中观察到瘘道。成功的随机双盲对照III期临床试验(ClinicalTrials.gov,注册号NCT01541579)利用扩增的同种异体AMSC(单次病灶内注射1.2×109细胞)治疗212名患有难治性复杂肛周瘘管的克罗恩病患者表明,解冻后培养至少24小时的恢复期可提高MSC的质量。
| 疾病 | MSCs的起源 | 治疗途径 | 确定的免疫调节作用 | 参考 | ||
|---|---|---|---|---|---|---|
| 临床前研究 | ||||||
| 卵巢癌小鼠模型 | 小鼠致密骨间充质干细胞 | 腹腔注射 | 激活CD4+和CD8+T细胞并抑制Tregs | [88 , 89] | ||
| 肾同种异体移植 | 小鼠骨髓间充质干细胞 | 静脉注射 | 抑制T细胞和改善Tregs生成 | [114] | ||
| 败血症小鼠 | HUC-间充质干细胞 | 静脉注射 | 提高抗炎作用,增加Treg细胞,促进巨噬细胞吞噬,增强修复性巨噬细胞,分泌更多VEGF | [171] | ||
| 哮喘小鼠 | 小鼠骨髓间充质干细胞 | 腹腔注射 | 更好的免疫调节作用 | [172] | ||
| 患有急性肝功能衰竭的小鼠 | 小鼠AMSC | 静脉注射 | 去除碎片并改善IL-6肝再生 | [173] | ||
| 小鼠炎症性肠病 (IBD) | 肠道淋巴集结 MSCs | 静脉注射 | 改善小鼠IBD模型症状 | [174] | ||
| GVHD小鼠 | 人类间充质干细胞 | 静脉注射 | PD-1 配体的参与、临床评分的降低和小鼠存活时间的延长 | [175] | ||
| 急性呼吸窘迫综合征 (ARDS) 小鼠 | HUC-间充质干细胞 | 静脉注射 | 改善 ARDS 的肺损伤并使 YAP 失活以促进 II 型肺泡上皮细胞 (AECII) 分化。 | [176] | ||
| 小鼠碱烧伤模型 | 小鼠骨髓间充质干细胞 | 局部注入 | 增强它们的免疫调节和促血管生成能力,减少促炎性 IL-1β | [177 , 178] | ||
| 宿主的免疫系统 | HUC-间充质干细胞 | 静脉注射 | 中性粒细胞百分比和中性粒细胞化学引诱物浓度的升高 | [179] | ||
| 临床试验 | ||||||
| 疾病 | MSCs的起源 | 治疗途径 | 临床试验编号 | 阶段 | 确定的免疫调节作用 | 参考 |
| 骨关节炎 | 自体骨髓间充质干细胞 | 关节内输液 | NCT02351011 | I/II临床试验 | 减少滑膜炎症和疼痛 | [161] |
| 类固醇难治性 III 级或 IV 级急性 GVHD | 自体骨髓间充质干细胞 | 静脉注射 | UMIN000006719 | II/III期临床试验 | 提高整体存活率 | [162] |
| 多发性硬化症 | 自体骨髓间充质干细胞 | 静脉注射 | NCT00395200 | IIa临床试验 | 改善结构、功能和生理 | [163] |
| 中度至重度特应性皮炎 | HUC-间充质干细胞 | 皮下注射 | NCT01927705 | I/II临床试验 | 严重程度评分和湿疹面积、特应性皮炎严重程度指数、瘙痒评分、血清 IgE 水平和血液嗜酸性粒细胞数量的减少 | [164] |
| 克罗恩病 | 自体骨髓间充质干细胞 | 瘘管内注射 | / | / | 一种可行、安全和有益的疗法 | [165] |
| 克罗恩病 | 同种异体AMSC | 瘘管内注射 | NCT01541579 | 三期临床试验 | 长期疗效和安全性 | [166 , 167 , 168 , 169] |
| 胃肠道腺癌 | 自体骨髓间充质干细胞 | 静脉注射 | 欧盟临床试验注册2012-003741-15 | I/II临床试验 | 良好的安全性和耐受性 | [180] |
然而,很明显,一些副作用的诱导可能是由MSCs相关治疗介导的。例如,最近的临床前研究表明,大脑微环境的急性低温调节了鼻内MSCs的功能,增强了持久的运动认知缺陷和内皮激活,导致促炎环境,增加了外周免疫细胞浸润,这加剧了缺氧缺血性大脑的脑损伤。
有希望的策略有可能提高未来试验的间充质干细胞的功效
临床前报告表明,MSCs的不同给药方式和修饰因子具有治疗不同疾病的潜力。最近的研究表明通过静脉内递送MSC或取决于内源性MSC的迁移和动员来归巢至损伤部位的MSC。MSCs (FGF21-MSC) 中成纤维细胞生长因子21 (FGF21) 的过表达表明,在创伤性脑损伤 (TBI) 小鼠模型中,MSCs对损伤部位的归巢能力得到改善。
提高MSCs有效性的另一个策略是促进其低温保存的方法。更具体地说,冷冻保存后新鲜解冻的 MSC 会阻碍功能特征,包括代谢活性和细胞凋亡的上调以及细胞增殖、免疫抑制能力、克隆形成能力和关键再生基因的下调。值得注意的是,24小时的适应期重新激活了解冻的细胞,减少了细胞凋亡并增强了高迁移率族箱 (HMOX-1) 和肿瘤坏死因子刺激基因6 (TSG-6) 基因的表达,具有抗炎作用和具有血管生成作用的VEGF基因表达。因此,MSCs应该标准化以实现稳健的质量和可靠性,特别是在大规模冷冻MSCs产品中。
结论和未来展望
由于MSCs对其他细胞类型的趋向性和免疫调节特性,MSCs的管理已成为临床前和临床研究中的一种新型治疗策略。由于MSCs通过与其他免疫细胞的相互作用和各种炎症细胞因子的相互作用而修饰的免疫调节能力,MSCs可以介导各种炎症性疾病的恢复。与MSCs免疫调节能力相关的主要机制包括细胞间联络和旁分泌活动,在这个过程中,MSCs被炎症刺激、细胞外囊泡、细胞因子、趋化因子或与其他免疫细胞共培养所修饰。因此,间充质干细胞移植可以成为一种可管理的、有潜力的、可行的无细胞治疗方法。
主要参考资料:Yang, G., Fan, X., Liu, Y.等。间充质干细胞的免疫调节机制和治疗潜力。 干细胞 Rev and Rep (2023)。https://doi.org/10.1007/s12015-023-10539-9。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号