尽管间充质干细胞(MSC)移植为终末期肝病(ESLD)提供了一种替代策略,但由于细胞植入效率低,MSC治疗的进一步广泛应用受到限制。提高细胞植入效率对于增强MSC对肝脏疾病的治疗起着至关重要的作用。
近日,福建医科大学孟超肝胆医院在《Stem Cell Research& Therapy》发表了一篇关于干细胞移植治疗终末期肝病的现状和挑战的综述,该综述还概述了复杂的细胞归巢过程,并强调低细胞植入效率与MSC归巢旅程所涉及的细胞外条件的巨大差异密切相关,这些条件包括体外恒定的受控条件到体内可变的挑战性条件。改善细胞存活和归巢能力可增强间充质干细胞植入功效。
增强干细胞的存活和归巢能力,提高干细胞移植治疗肝病的功效

因此,我们总结当前的策略,包括低氧启动、药物预处理、基因修饰和细胞因子预处理,以及脾切除和局部照射,用于提高MSC的存活和归巢能力,增强MSC治疗的细胞植入和治疗效率。我们希望这篇综述能够为提高间充质干细胞移植治疗肝脏疾病的效率提供新的见解。
介绍
终末期肝病(ESLD),包括失代偿性肝硬化、肝功能衰竭和肝细胞癌,死亡率很高,近年来发病率也有所上升。ESLD以肝功能严重异常为特征,包括肝功能失代偿、门静脉高压、凝血功能障碍、黄疸、肝肾综合征、肝性脑病和腹水。虽然肝移植能有效治疗这些疾病,但由于供体器官短缺,大多数患者在等待移植手术时死亡。间充质干细胞(MSCs)是一种成人多能细胞,具有自我更新、多向分化、免疫调节和旁分泌功能。
最近的研究结果表明,间充质干细胞移植可改善急性或慢性肝病患者的肝功能,为ESLD患者提供了延长生命的另一种策略。间充质干细胞移植的治疗功能主要体现在以下几个方面。
- 首先,间充质干细胞可通过转分化或细胞融合替代肝细胞,促进肝组织修复和再生。
- 第二,间充质干细胞释放生长因子和细胞因子,抑制肝细胞凋亡,刺激肝脏再生,从而发挥旁分泌功能。
- 第三,间充质干细胞具有与适应性和先天性免疫反应相关的免疫调节特性。
根据MSC治疗的潜在治疗机制,MSC的旁分泌或免疫调节作用取决于其在体内的存活率,而MSC的肝分化或融合功能取决于到达受损肝组织的存活MSC的数量。因此,MSC植入效率与细胞存活或活力以及细胞向肝脏的充分递送密切相关。事实上,郭等人发现移植后4周肝组织中MSC的存活率低于5%。我们前期的工作表明,小鼠纤维化肝脏移植后1天内大量MSCs死亡,移植后11天存活的MSCs几乎完全消失,表明MSC体内存活率极低,导致肝病细胞移植效率不足。因此,细胞损耗已成为MSC治疗肝病的主要瓶颈。需要提高细胞存活率和MSC归巢能力以提高细胞植入效率,以最大限度地发挥间充质干细胞移植在肝脏疾病中的治疗潜力。
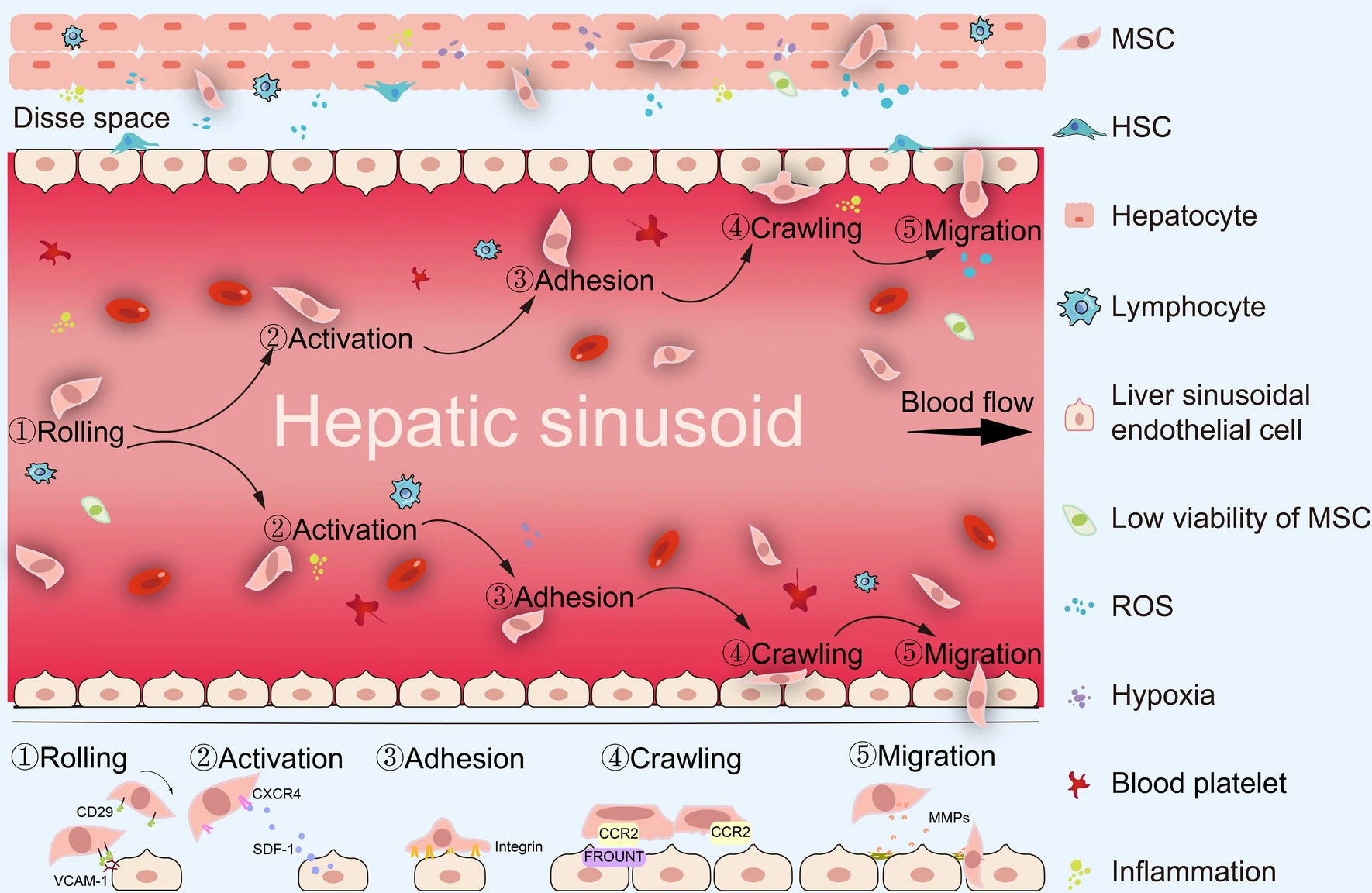
各种生物、生化和生物物理因素通过细胞、细胞外基质和体外和体内生物活性因子之间的相互作用紧密影响MSC的存活和归巢能力。体外和体内条件的显着不同严重影响移植后MSC的存活或活力。在MSC的体外扩增过程中,包括氧分压在内的条件得到最佳控制,而MSC在体内会遇到各种条件,包括缺氧和氧化应激,这些条件会影响它们在移植过程中归巢和有效重新填充肝组织的能力(图1)。自导引过程的各个部分包括滚动、激活、粘附、爬行和迁移(图2)影响MSCs归巢至肝实质组织的数量。
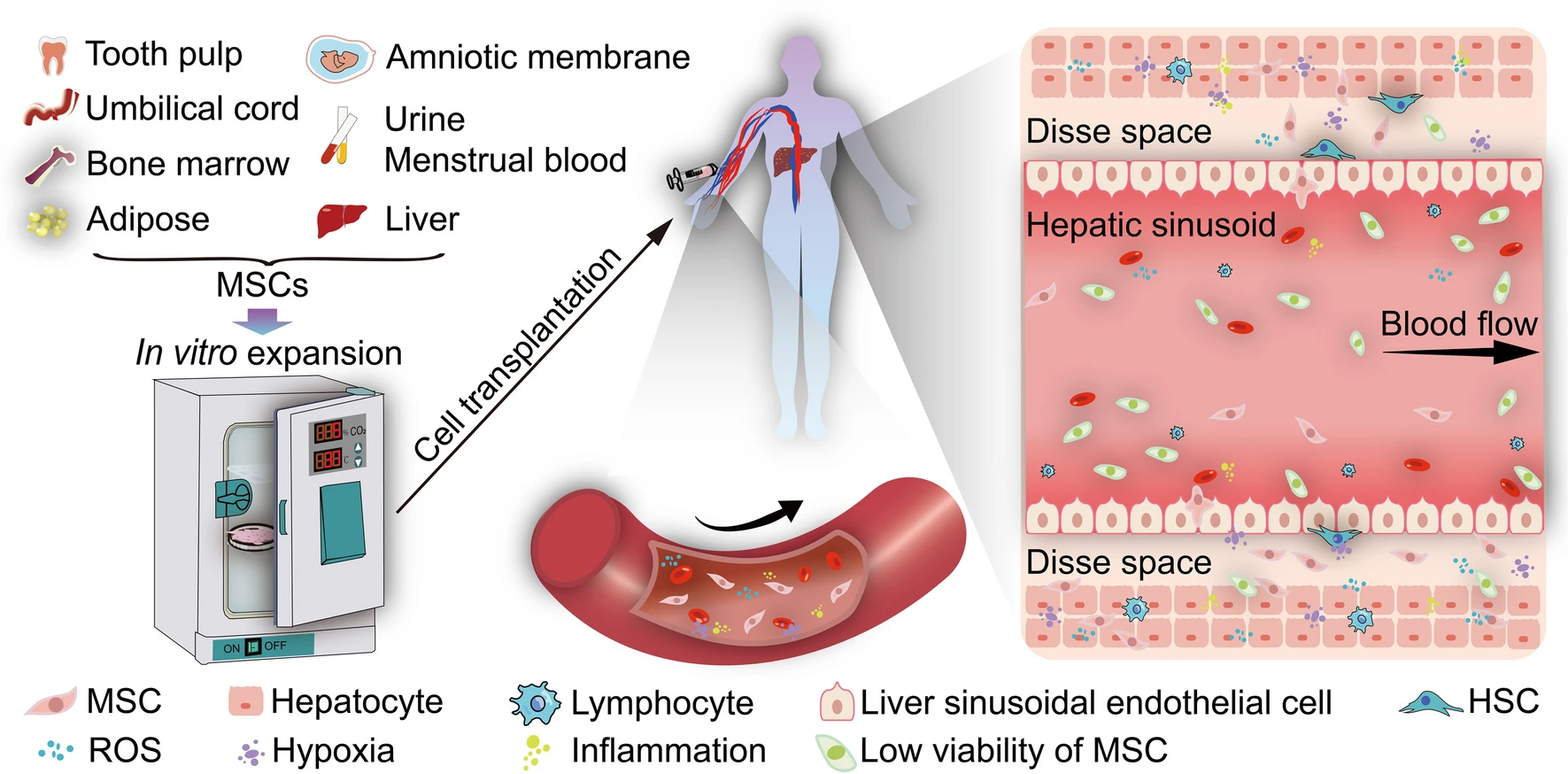
MSC植入过程曲折,移植的MSC会经历从体外舒适生长条件到体内恶劣环境(如缺氧、氧化应激和炎症)的剧烈变化,导致MSC治疗肝脏的细胞存活率较低疾病。
间充质干细胞移植治疗终末期肝病的现状和挑战
MSC移植已广泛用于临床前研究,用于治疗ESLD,包括肝衰竭和肝硬化,表明其在人类中治疗ESLD的潜力。越来越多的临床试验证实了MSC移植对ESLD的治疗潜力,特别是失代偿性肝硬化(DLC)和慢加急性肝衰竭(ACLF)(表1)。
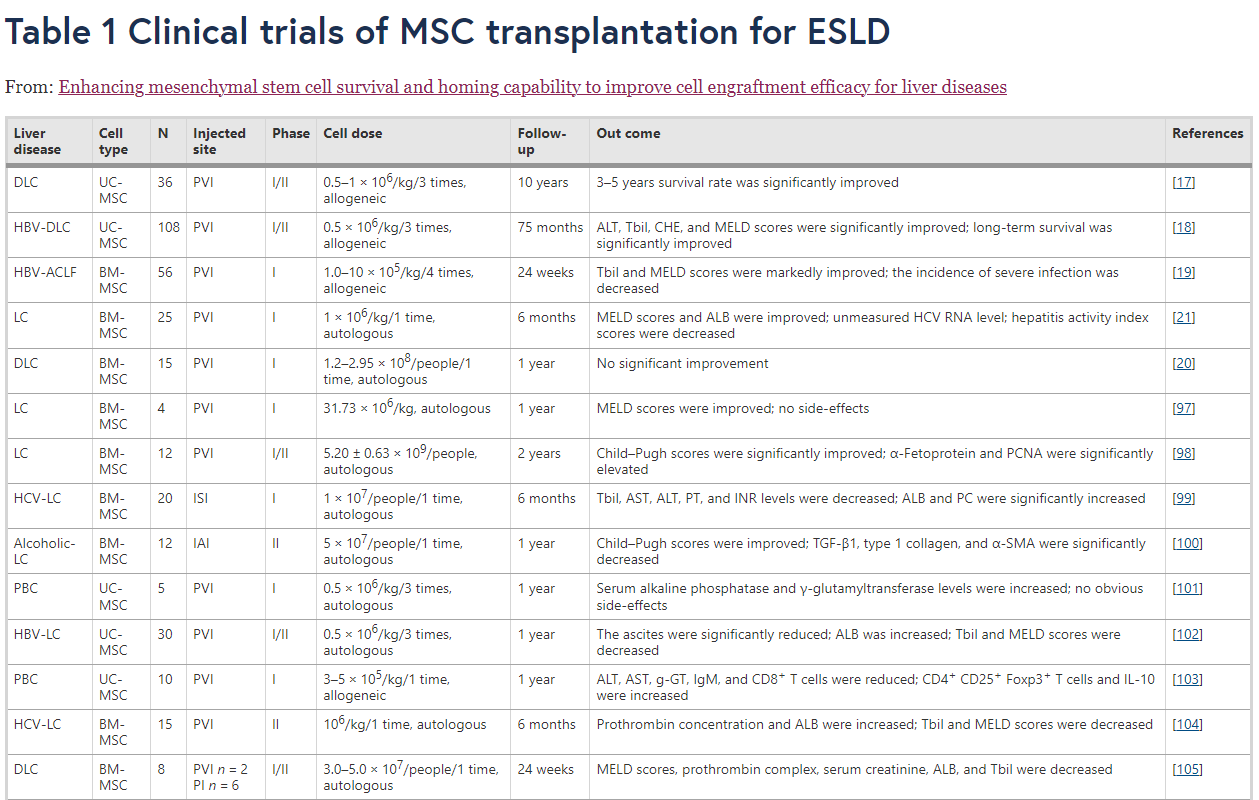
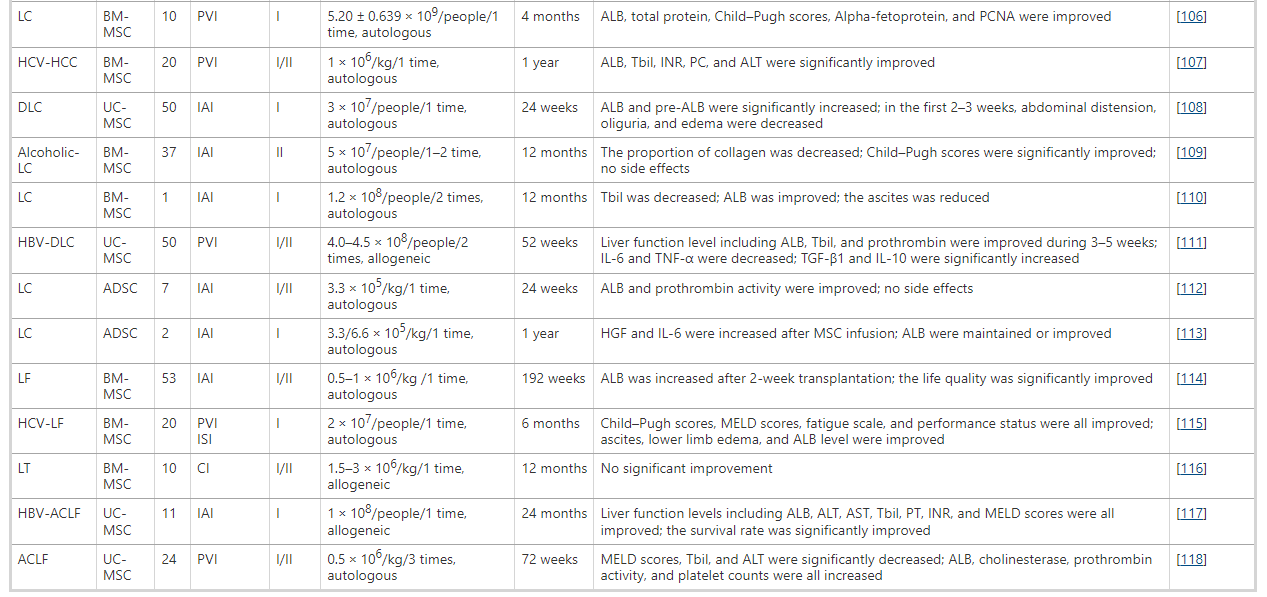
ACLF,慢性肝衰竭急性发作;ADSC,脂肪来源的MSC;ALB,白蛋白;ALT,丙氨酸转氨酶;α-SMA、α-平滑肌肌动蛋白;AST,天冬氨酸转氨酶;BM-MSC,骨髓来源的MSC;CHE,胆碱酯酶;CI,中央静脉注射;DLC,失代偿性肝硬化;HBV,乙肝病毒;HCC,肝细胞癌;HCV,丙型肝炎病毒;IAI,肝动脉注射;IL,白细胞介素;INR,国际标准化比率;ISI,脾内注射;LC,肝硬化;LF,肝功能衰竭;LT,肝移植;MELD,终末期肝病模型;PBC,原发性胆汁性肝硬化;PC,凝血酶原浓度;PCNA,增殖细胞核抗原;PI,门静脉注射;PVI,外周静脉注射;PT,凝血酶原时间;Tbil,总胆红素;TGF-β1、转化生长因子-β1;肿瘤坏死因子-α, 肿瘤坏死因子α;UC-MSC,脐带来源的 MSC
李等人发现在13至75个月的随访期间,人脐带血来源的MSC治疗显着改善了3年(83.3%vs61.8%)和5年(63.9%vs43.6%)的总生存率对于DLC患者 (n=36)。
在一项随机对照临床试验中,间充质干细胞移植在DLC患者的13-75个月随访期间改善了总体生存率和肝功能生物标志物(48周随访期间的白蛋白、凝血酶原活性、胆碱酯酶和总胆红素)n=108) 。DLC患者接受MSC治疗后,未观察到明显的副作用或细胞相关并发症。
Lin等人进行的一项随机对照试验。发现MSC治疗可以通过改善ACLF患者的肝功能(总胆红素和MELD评分)并降低严重感染的发生率(16.1%vs33.3%)来提高24周生存率(73.2%vs55.6%)(n=56)。
然而,穆罕默德内贾德等人。发现在一项涉及肝硬化患者的随机对照试验(n=27,随访12个月)中,MSC移植并没有改善儿童评分、MELD评分、血清白蛋白、INR、血清转氨酶或肝脏体积。鉴于世界范围内肝病的背景和指南并不完全统一,MSC治疗肝病亚类的临床获益还需要开展一些大型、多中心、长期随访的临床试验,以进一步证实MSC治疗的临床获益。
更重要的是,在解释间充质干细胞移植治疗肝病的疗效时,应考虑细胞植入效率,包括间充质干细胞靶向递送至肝实质组织的存活率和数量。 值得注意的是, Kantarcıoğlu等人在接受MSC治疗6个月后对肝硬化患者 ( n=25)进行了一系列肝脏活检。发现间充质干细胞无法以足够的量输送到肝组织中。因此,细胞植入效率低严重影响MSC治疗肝病的长期治疗效果。接下来,我们将描述细胞归巢过程以及如何提高细胞植入效率,以增强间充质干细胞对肝病的治疗功效。
间充质干细胞移植及体内归巢过程
根据之前的综述,MSC归巢可分为系统性和非系统性。对于非系统性归巢,将间充质干细胞局部注射到目标部位。在全身归巢中,间充质干细胞被注入血流,穿过循环系统,最后迁移到目标部位。在肝脏疾病中,MSC归巢是全身性的,因为MSC移植通常是通过不同途径(包括外周静脉和肝门静脉)进行静脉 (IV) 注射来实现。静脉移植后,间充质干细胞最初保留在肺部,然后输送到肝脏、脾脏和肾脏。很少有间充质干细胞位于其他器官。尽管输送途径影响间充质干细胞到达损伤部位的行进,但门静脉和外周静脉给药之间能够迁移到实质肝组织的细胞数量没有显着差异。
此外,在急性肝衰竭或肝硬化模型中,外周静脉和门静脉给药间充质干细胞的治疗效果没有差异。考虑到MSC的存活和归巢能力与MSC治疗的疗效密切相关,静脉注射的MSC,无论注射部位如何,都会经历相似的体内微环境和相同的全身归巢过程。相关的,已经证实静脉注射后全身归巢是不可避免的,并且涉及主动或被动的MSC外渗,然后是趋化因子引导的间质向损伤部位迁移。与内源性白细胞向炎症部位迁移类似,全身施用的间充质干细胞经历滚动、激活、粘附、爬行和迁移(图2)。
增强肝脏疾病中MSC存活和归巢能力的策略
进入血液后,间充质干细胞将遇到一系列可能影响其生存的条件。支持体外生长的最佳恒定条件让位于更多体内恶劣、复杂的条件,包括低氧张力、流体压力以及与全血成分的相互作用。
结果,许多间充质干细胞在静脉移植后在血液循环中死亡。此外,在曲折的归巢过程之后,现有的存活MSCs继续受到靶向部位的缺氧、氧化应激和炎症等挑战性条件的影响,导致细胞持续死亡,使得只有少量存活的MSCs在细胞内生长。肝实质组织。细胞损耗极大地降低了MSC移植在肝脏疾病中的理论功能。考虑到细胞存活和细胞归巢能力与MSC植入效率密切相关,有必要进一步提高MSC的存活和归巢能力,最大限度地发挥MSC治疗肝病的治疗效果。接下来,我们总结了当前增强MSC移植的细胞存活和归巢能力的策略(图3)。
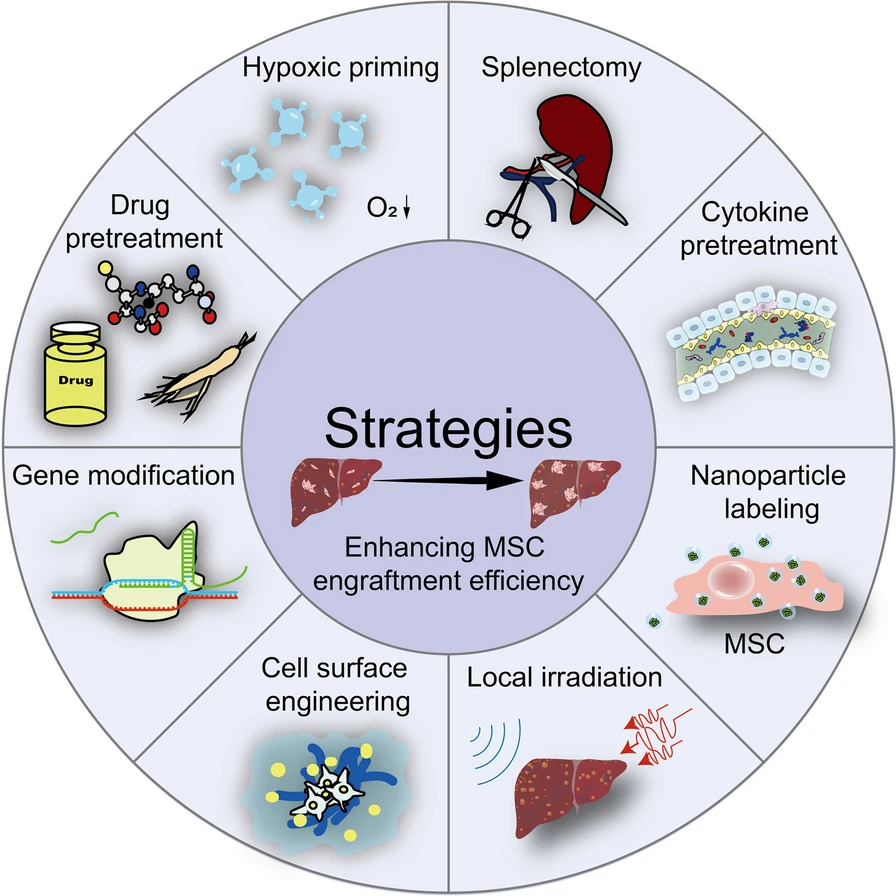
目前的策略包括低氧启动、药物预处理、基因修饰、细胞表面工程、细胞因子预处理、脾切除、纳米颗粒标记和局部照射,已被用于提高MSC的存活和细胞归巢能力。
提高间充质干细胞体内存活率的策略
缺氧启动:一般来说,人体动脉血含12.3%O2,静脉血含5.3%O2,肝组织含约4.04%O2(30.7mmHgO2)。与常氧培养的MSCs(NC-MSCs,约19.95%O2 )的体外扩增相比,体内的氧溶解以及肝组织和循环系统中的氧含量极低。短期缺氧后,NC-MSCs由于Sug1上调和26S蛋白酶体失活而容易死亡,导致免疫原性增加,诱导细胞凋亡。此外,NC-MSC干性在体外广泛扩增过程中很容易丢失。
因此,NC-MSC的体内扩增很难适应氧压的剧烈变化。为了提高间充质干细胞适应氧气变化的能力,低氧启动(一种体外预处理方法)已被用来提高其体内存活率。缺氧启动可以增加MSCs分泌的自分泌或旁分泌因子,包括IL-6、TNFα、HGF、VEGF和前列腺素E合酶,从而促进肝再生并减少肝细胞凋亡。此外,它还通过促进自噬来预防MSC衰老,并下调p16、p53和p21。因此,低氧启动已被用来增强MSC治疗肝病的效果(表2)。

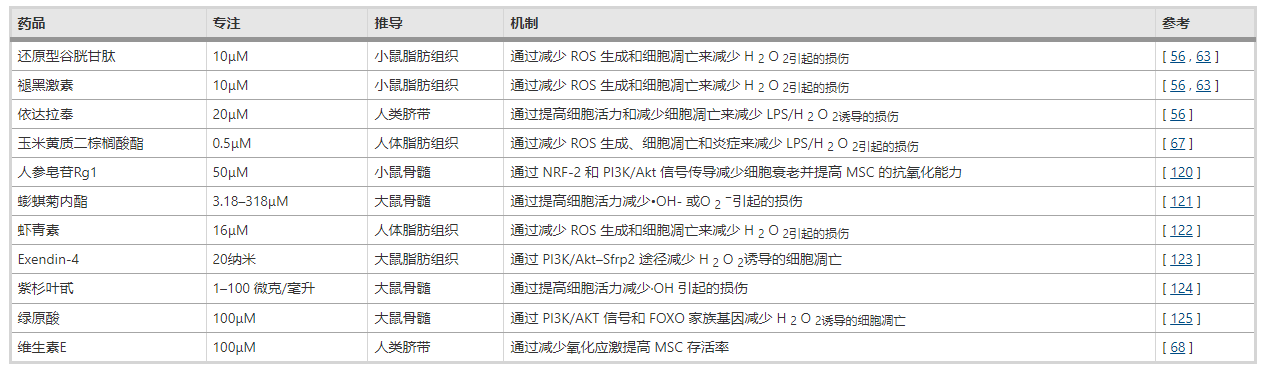
药物预处理:越来越多的证据表明,以活性氧过度产生为特征的氧化应激是移植间充质干细胞细胞存活率低的关键因素。抗氧化药物已被用来克服氧化应激并提高MSC 的体外存活率(表3)。
事实上,我们的小组发现低剂量的还原型谷胱甘肽(GSH)和褪黑激素可用于保护间充质干细胞功能(包括细胞增殖和干细胞性)并减少长期体外传代过程中的细胞衰老。重要的是,抗氧化剂预处理通过减少H2O2损伤模型中的细胞凋亡来增加MSC存活率并增强MSC治疗肝纤维化的治疗效果。使用其他抗氧化剂进行预处理,包括依达拉奉、玉米黄质二棕榈酸酯和维生素E,也可用于增强间充质干细胞的存活率和肝衰竭的治疗效果。
基因修饰:鉴于miR-210与缺氧或氧化应激下的细胞存活密切相关,其过表达已被用来增强MSC在缺氧条件下的存活或H2O2诱导的氧化应激,从而改善修复功能MSC移植。抗凋亡、抗氧化或促生存基因的过度表达,包括BCL-2、Akt1、HGF、GATA-4和促红细胞生成素 (EPO),显着增强MSC的体外和体内存活率。此外,miR-34a的下调,而miR-16通过减少细胞凋亡来增强MSC的存活。因此,改变基因表达以减少细胞凋亡和/或提高对缺氧和氧化应激的适应性是增强MSC体内存活的另一种方法。
增强间充质干细胞体内归巢能力的策略
MSC体外修饰
基因修饰:MSC归巢的整个过程是由配体和受体之间的串扰控制的。增加MSC上配体或受体的表达可提高其归巢能力。过表达迁移相关基因,包括CXCR-4、CCR-2、CXCL-9和c-Met,已被用来增加MSC归巢。基因修饰还显着增强MSC对急性或慢性肝病的治疗功效(表4)。

细胞表面工程:在细胞表面修饰目标分子的细胞表面工程已被用来增强 MSC 向目标位点的递送。此前,人类脂肪组织来源的间充质干细胞表面采用脂质偶联肝素进行改造,以增加间充质干细胞的肝脏归巢并改善间充质干细胞对急性肝衰竭的治疗。
细胞因子预处理:用细胞因子(包括IL-17和HGF)进行预处理,可以改善MSC体内的迁移和归巢能力。
纳米颗粒标记:基于纳米颗粒的成像已广泛用于MSC生物分布的体内评估。黄等人开发了一种用于MSC标记的铁基纳米簇,发现它通过促进CXCR-4表达来增强MSC迁移。
宿主环境调节
脾切除术:门脉高压是肝硬化加重的典型身体状况。此前,有人认为流动剪切应力有利于间充质干细胞的成骨、心血管、软骨、脂肪和神经分化。然而,高剪切应力和门静脉高压阻碍了MSC的粘附和迁移。脾切除术是门脉高压和肝硬化患者增加血小板计数和促进肝再生的一种治疗选择。
瞬时局部照射:考虑到瞬时局部照射(TLR)会扰乱LSEC屏障并抑制Kupffer细胞的吞噬功能,因此TLR已被用于增强肝切除小鼠的肝细胞植入。
结论和未来方向
在此,我们回顾了间充质干细胞移植的整个细胞归巢过程以及间充质干细胞治疗肝脏疾病的临床现状,强调细胞移植效率低是间充质干细胞治疗的使用和长期疗效面临的主要挑战。
我们还强调,细胞存活和间充质干细胞向肝实质组织的迁移与间充质干细胞的移植效率密切相关。因此,我们总结了目前提高间充质干细胞移植治疗肝病的细胞存活率和归巢能力的策略。
目前的策略得到了体外和动物研究的支持,但其在肝脏疾病中改善细胞存活和间充质干细胞治疗归巢能力的临床转化潜力仍有待测试。或化学方法是提高间充质干细胞植入效率的替代方法;然而,生物安全问题以及如何实现GMP级细胞生产还需要进一步探索。
除了细胞存活率和归巢能力,还有大量变量,包括来自不同组织的间充质干细胞的异质性和患者的个体差异,这些都会影响细胞移植效率和间充质干细胞治疗肝病的个性化。显然,有必要开发个性化模型来解决间充质干细胞移植治疗肝病的疗效问题。
参考资料:Yu, S., Yu, S., Liu, H. et al. Enhancing mesenchymal stem cell survival and homing capability to improve cell engraftment efficacy for liver diseases. Stem Cell Res Ther 14, 235 (2023). https://doi.org/10.1186/s13287-023-03476-4
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号