帕金森病 (PD) 是继阿尔茨海默病之后第二常见的神经退行性疾病。PD影响全球超过600万人,主要是65岁以上的人。PD发病的平均年龄为55岁,而发生PD的主要危险因素是衰老。大约10%的PD患者患有年轻发病的PD,定义为21至50岁之间的诊断,更有可能是家族性或遗传性。对于迟发性PD,患者通常被诊断为70岁以上。

帕金森病的临床表现是运动功能障碍,其特点是运动迟缓、肌肉强直、静息性震颤和姿势不稳。大多数与PD相关的神经退行性过程是由病理性α-突触核蛋白 (α-syn) 的积累驱动的,它是一种突触前神经元蛋白,在神经系统中聚集形成路易体 (LBs) 和路易神经突 (LNs) 。
PD患者的运动障碍很常见,并且随着年龄的增长而显著增加。PD最常见的症状是震颤,通常在休息时发生,但随着自主运动而减弱。其他非运动症状包括嗅觉减退、便秘、焦虑、抑郁、体位性低血压、泌尿功能障碍、快速眼动睡眠行为障碍和认知功能障碍。一部分PD患者还会出现心理健康问题,例如抑郁症和痴呆症。伴有痴呆的PD通常在运动功能障碍发作后数年出现,估计30-80%的受影响个体。
PD的确切原因仍然未知。高龄被认为是PD的最大危险因素。衰老会导致黑质 (SN) 内的一系列压力源,从而削弱神经元及其对进一步损伤作出反应的能力。环境和遗传因素都被认为会影响疾病风险和进展。只有大约10%的PD病例可直接归因于遗传因素。
关于环境因素,据报道,脑血管损伤、反复头部外伤、精神抑制药物、接触杀虫剂、吸烟、咖啡因摄入和锰中毒都会增加患帕金森症的风险。
帕金森病理生理学
在病理学方面,中脑SN致密部 (SNpc) 中多巴胺能 (DA) 神经元的丢失以及剩余DA细胞中称为LB的细胞质蛋白聚集体的存在是PD的标志(图1)。SNpc神经元形成黑质纹状体DA通路;因此,SNpc神经元的缺失会导致纹状体多巴胺缺乏,从而导致PD的主要症状。因此,通过口服多巴胺前体左旋多巴 (L-DOPA) 补充纹状体多巴胺可缓解大部分症状。
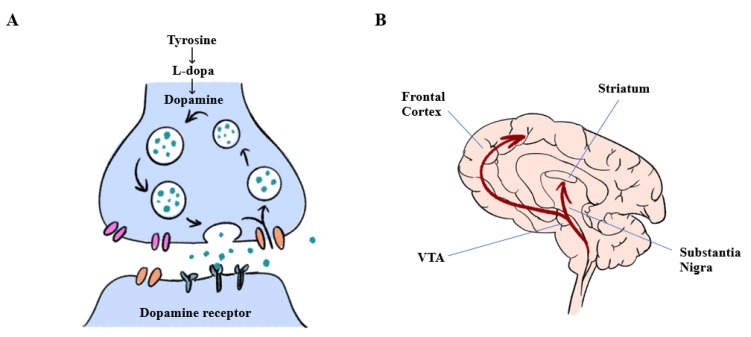
( A ) 用于多巴胺生物合成的酶在中脑多巴胺能神经元中特异性表达。酪氨酸羟化酶 (TH) 将酪氨酸转化为L-多巴,再由芳香族L-氨基酸脱羧酶进一步转化为多巴胺。
( B ) 中枢神经系统中的多巴胺通路。VTA:腹侧被盖区。
DA神经元的退化导致纹状体中多巴胺的阈值降低约80%,从而导致出现运动症状。DA神经元的死亡与线粒体功能障碍、氧化应激、神经炎症和自噬或蛋白酶体蛋白降解不足有关。随着黑质纹状体DA结构和功能的丧失,PD也会影响中枢神经系统的许多其他区域。
传统药物治疗帕金森的优劣势
尚未发现治疗PD的方法。缓解运动症状的药物疗法主要旨在使用多巴胺激动剂、单胺氧化酶 (MAO)-B抑制剂和左旋多巴加卡比多巴恢复纹状体多巴胺张力。
多巴胺替代疗法需要使用左旋多巴,因为多巴胺不能穿过血脑屏障。一旦左旋多巴到达大脑,它就会被存活的黑质纹状体神经元的末端转化为多巴胺,也可能被小胶质细胞和血清素能神经元转化为多巴胺。
药物通过增加或替代纹状体多巴胺浓度来帮助管理与运动功能相关的问题,例如行走、运动和震颤。这些药物包括左旋多巴、多巴胺激动剂、MAO-B抑制剂、COMT抑制剂、抗胆碱能药和金刚烷胺。尽管这些药物不会改变疾病进程或治疗PD的非运动方面,但它们可能会导致大多数患者运动症状的显著改善,尤其是在疾病的早期阶段。然而,药物的益处通常会随着时间的推移而减弱,并且在控制症状方面变得不那么一致。上述药物也可能导致有问题的副作用。
近年来,随着干细胞技术的发展,干细胞应用于帕金森上的治疗越来越多,且展现了不错的疗效,给这部分患者带来了新的希望。
干细胞移植技术治疗帕金森病优势及潜力
随着对PD的病因和发病机制的更好理解,一些重要的途径已被揭示为潜在治疗的目标。缓解PD症状阶段的传统治疗策略仍然存在,但随着新的遗传学见解,有可能对有发展PD风险的人使用预防性神经保护治疗,从而延缓疾病的发作和进展。在努力预防和控制症状性PD的同时,研究人员还在研究干细胞作为患病神经元或退化组织的替代品。
间充质干细胞移植被认为是最有希望治疗帕金森病的的疗法。将间充质干细胞移植到DA耗尽的纹状体中可以恢复DA神经传递,以替代PD患者丢失的神经元。临床试验表明,间充质干细胞移植可缓解PD患者的神经系统症状并恢复运动功能。
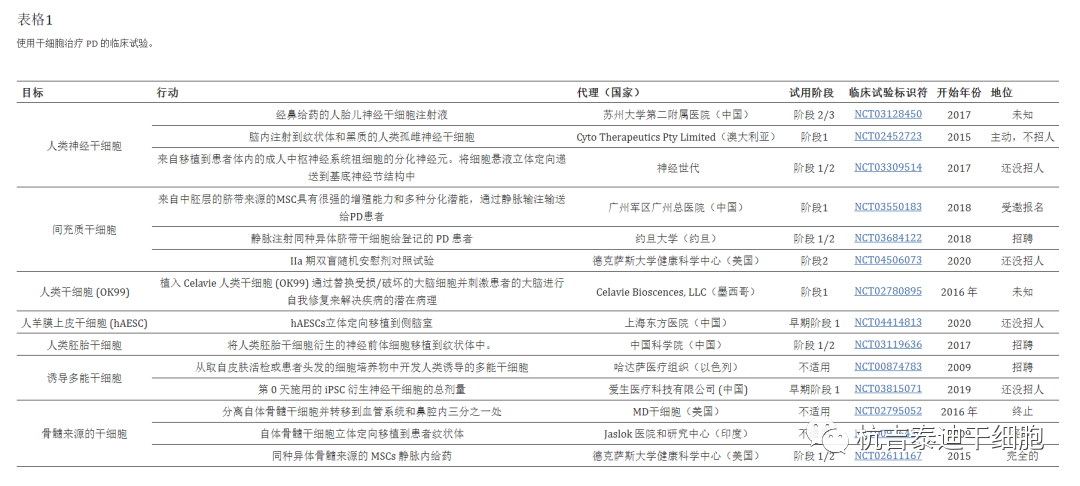
间充质干细胞:间充质干细胞治疗包括帕金森病在内的许多疾病有益。由于MSCs具有低免疫原性、无畸胎瘤风险、伦理问题少以及移植到人体后致瘤的可能性低,因此使用MSCs作为治疗剂的临床试验正在进行中。表格1)。
间充质干细胞可以从各种来源中分离出来,包括骨髓抽吸物、脂肪组织、成人组织的外周血和新生儿组织的脐带沃顿氏凝胶。人脐带间充质干细胞因其多向分化能力、自体移植可行性、易于获取和缺乏伦理问题而成为治疗应用的理想选择。
多能干细胞衍生的神经元祖细胞:多能干细胞 (PSC),例如胚胎干细胞 (ESC) 和iPSC,可以分化为多种细胞类型,包括具有DA特性的神经元。由于PSC可以通过无限复制进行自我更新,因此可以获得无限数量的可用于神经移植的细胞。基于iPSC的细胞替代疗法自山中伸弥发现以来已广受欢迎,因为iPSC具有与ESC相似的分化潜力,但伦理问题较少。
关于临床试验,人源iPSC衍生的DA细胞必须在临床前非人灵长类动物模型上进行测试,并具有更长的移植后安全性和有效性观察结果。在MPTP诱导的灵长类PD模型中,hPSC衍生的DA祖细胞被证明可以作为中脑DA神经元存活、成熟和发挥良好功能,至少两年内不会在脑中形成肿瘤。有了这些令人鼓舞的临床前结果,使用hESC/iPSC衍生细胞产品治疗PD的临床试验已在澳大利亚 (NCT02452723)、中国 (NCT03119636) 和日本 (JMA-IIA00384, UMIN000033564) 开始,但风险管理比其他使用MSCs的临床试验。
诱导多能干细胞治疗帕金森的优缺点
包括MSCs在内的基于细胞的疗法已经在临床前和临床上进行了测试,许多结果表明它们可以通过用正常神经元替换退化的神经元来纠正疾病状态。图2) 。然而,由于存在可能影响移植的功能性细胞的内源性病理蛋白,治疗效果可能无法维持一段令人满意的时间。
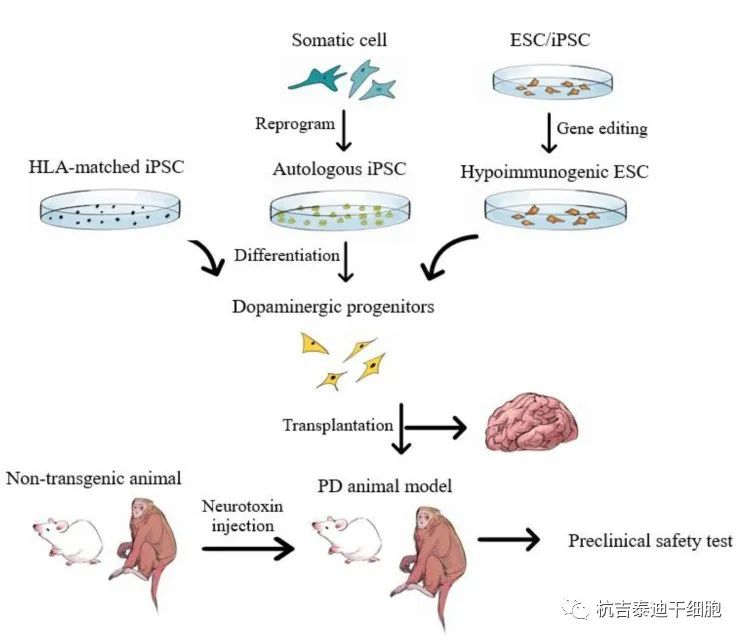
多巴胺能祖细胞可以从不同来源的多能干细胞中获得,这些干细胞要么通过表观遗传重编程来自体细胞,要么来自体外受精衍生的人类胚胎。HLA匹配的iPSC或基因编辑的低免疫原性ESC/iPSC可降低移植物诱导排斥的风险。啮齿动物和非人灵长类动物神经毒素诱导的PD模型的临床前试验显示出有希望的治疗效果。IVF:体外受精;HLA:人类白细胞抗原。
优势:iPSC和ESC衍生的DA神经元在移植到动物身上后都可以存活,生长出支配大脑的轴突,并支持从神经毒素引起的运动缺陷中恢复功能。如前一节所述,产生自体植入物需要将患者的成纤维细胞重新编程为iPSC,这是iPSC衍生细胞优于ESC衍生细胞的潜在优势。使用患者iPSC衍生的神经移植产品可避免ESC衍生或胎儿同种异体移植物存活所需的免疫抑制。
缺点:然而,临床级自体iPSC系的生成既耗时又昂贵,并且可能需要对遗传熟悉的PD患者的致病基因进行额外的基因编辑。为了克服这些限制,从“健康”和良好表征的供体中产生低免疫原性和通用iPSC系可能是一种选择。
结论
临床前研究表明,干细胞治疗帕金森病等神经退行性疾病方面具有巨大潜力。这篇综述着重于干细胞治疗的优势和潜力。然而,干细胞治疗存在许多问题和障碍。
总之,干细胞治疗目前处于起步阶段,需要大力推进。对于非运动改善,我们需要新的实验系统来开发对症疗法。
未来展望
目前对PD的治疗侧重于通过恢复DA活性来进行症状管理,但并未解决进行性神经退行性变。存在对疾病改善疗法的明确医疗需求。干细胞研究可能会导致激进的新疗法的发展,这些疗法已被提议作为目前缺乏有效治疗的几种神经退行性疾病的新方法。
与几年前相比,干细胞及其后代在动物模型中行为恢复的机制得到了更好的理解。除了更换细胞外,众所周知,间充质干细胞(如MSCs)会导致改善,这也可能通过免疫调节、营养作用、神经保护和刺激血管生成而具有临床价值。干细胞研究的这些进步可能会在未来几年内导致大量科学合理的神经退行性疾病临床试验。
参考资料:Liu Z, Cheung HH. Stem Cell-Based Therapies for Parkinson Disease. Int J Mol Sci. 2020 Oct 29;21(21):8060. doi: 10.3390/ijms21218060. PMID: 33137927; PMCID: PMC7663462.
本推文的目的不是提供具体的医疗建议,而是为用户提供信息,以更好地了解他们的健康状况和诊断出的疾病。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号