肌萎缩侧索硬化症 (ALS)也被称为渐冻症,是一种致命的神经退行性疾病,其特征是皮质和脊髓进行性运动神经元 (MN) 退化。通常由于呼吸系统功能障碍,在诊断ALS后3-5年内死亡。全球ALS的总体粗发病率和发病率分别为0.442‱和0.159‱。与女性相比,男性更容易受到ALS的影响。

渐冻症被认为是遗传和环境因素共同作用的结果。ALS以两种形式存在:家族性ALS (fALS) 和散发性ALS (sALS)。fALS表现出孟德尔遗传模式,占所有病例的5-10%。其余90-95%没有明显遗传联系的病例被归类为sALS。
渐冻症的临床症状多种多样,主要症状包括四肢无力、肌肉萎缩和同时累及上下MNs的肌束颤动。ALS的发病通常可分为两种亚型:脊髓型和延髓型。除了MN症状外,一些患者还会出现额颞叶痴呆,这可能会导致认知和行为改变。
目前,依达拉奉和利鲁唑是仅有的两种获得美国食品药品监督管理局(FDA)批准的药物;但是,只有利鲁唑可以短期延长患者的寿命,而依达拉奉可以提高生活质量。
在过去几年中,由于干细胞的分化、神经保护和免疫调节特性,越来越多地关注渐冻症的干细胞疗法。几项临床试验已经检查了多种类型和资源的干细胞,包括多能胚胎干细胞 (ESC)、诱导多能干细胞 (iPSC)、多能间充质干细胞 (MSC)、神经前体细胞和单核细胞 (MC)。这篇综述讨论了最近关于干细胞治疗渐冻症的研究结果。讨论了潜力和挑战,以提供对未来精准细胞治疗策略的见解。
干细胞移植治疗渐冻症的临床研究进展
目前,对于ALS没有有效的治疗选择,可以显著减轻甚至逆转疾病表型。这可能归因于我们对ALS的病理生理学和变异性知之甚少。最近,干细胞疗法通过靶向多种致病机制,主要是神经炎症,成为渐冻症治疗的新希望。图1)。干细胞治疗渐冻症的最新进展、治疗潜力和挑战将在以下小节中讨论(表1–3)。
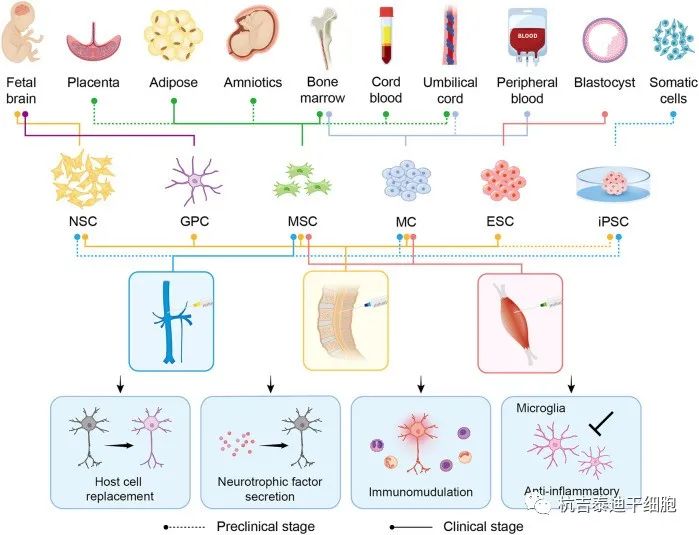
示意图中显示了六种主要的候选细胞类型(NSC、GPC、MSC、MC、ESC 和iPSC)。每种细胞类型的不同衍生和干预方法由不同颜色和类型的线条表示。线的类型(虚线或实线)显示层次结构,代表单独在临床前研究中或已经在临床阶段中的应用。在中间面板中,蓝色、黄色和红色分别代表静脉内、鞘内和肌肉内注射。移植的细胞通过宿主细胞替代、神经营养因子分泌、免疫调节和抗炎发挥其治疗作用。
NSC:神经干细胞;GPC:胶质祖细胞;MSC:间充质干细胞;MC:单核细胞;ESC:胚胎干细胞;iPSC:诱导多能干细胞。
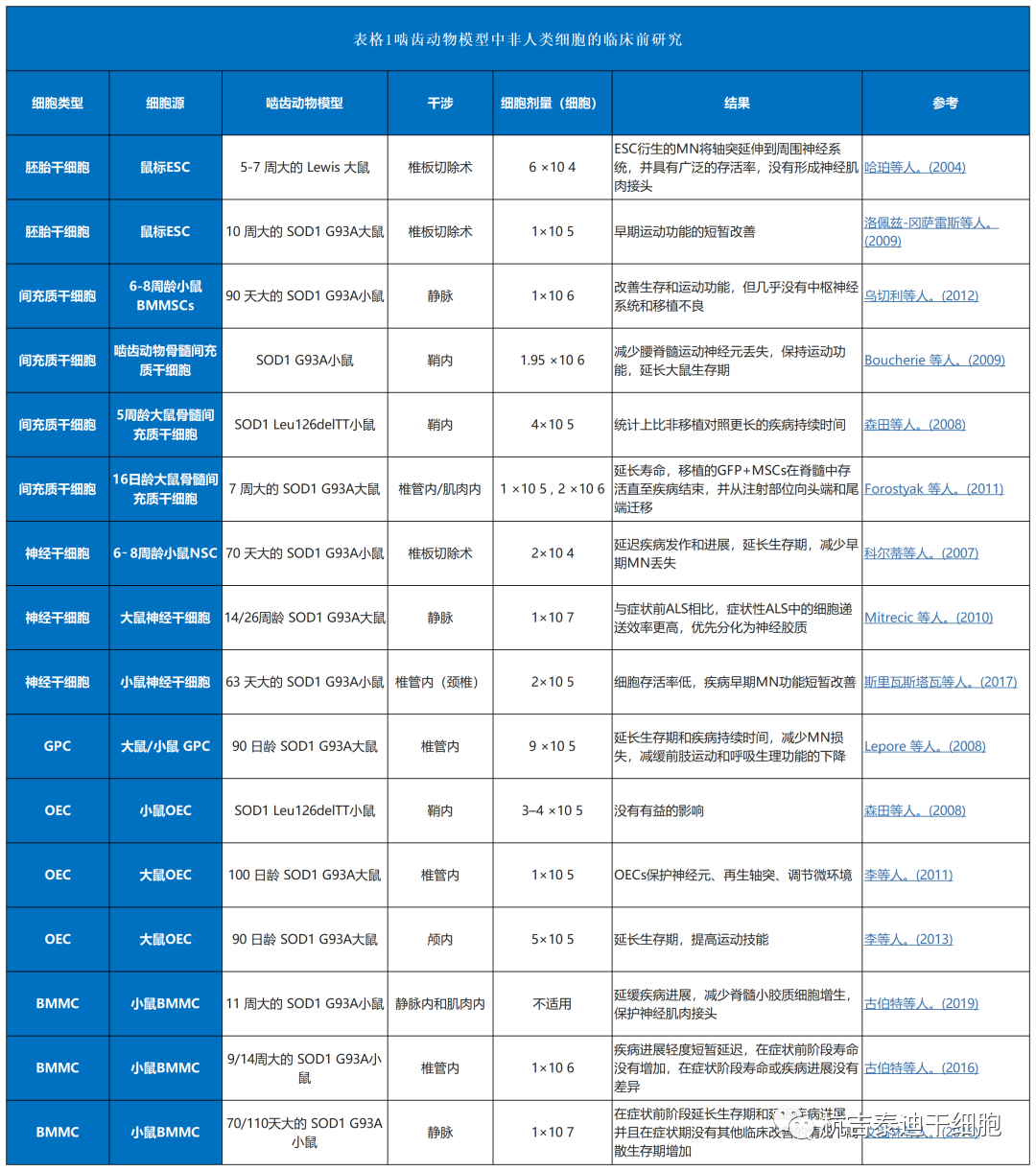
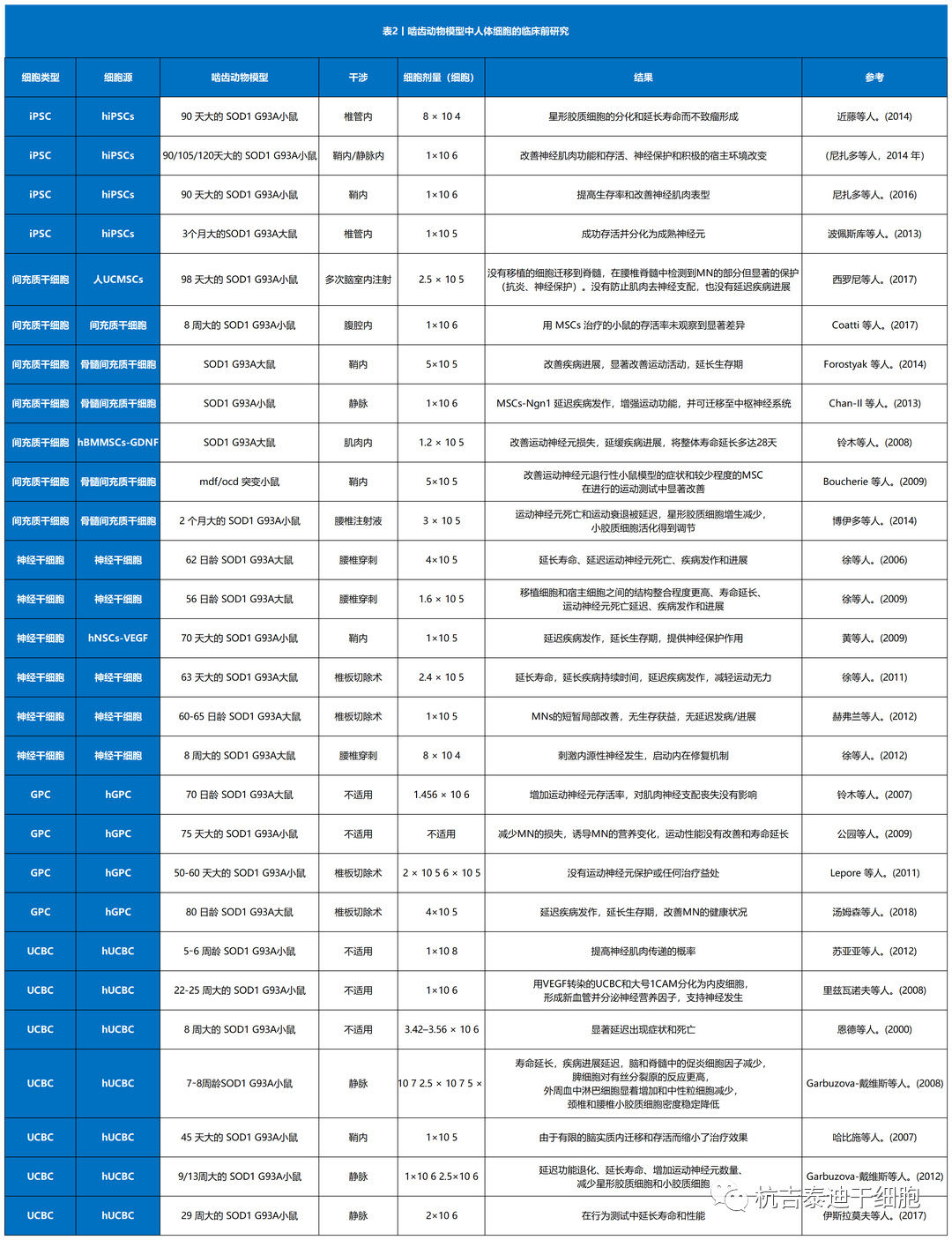
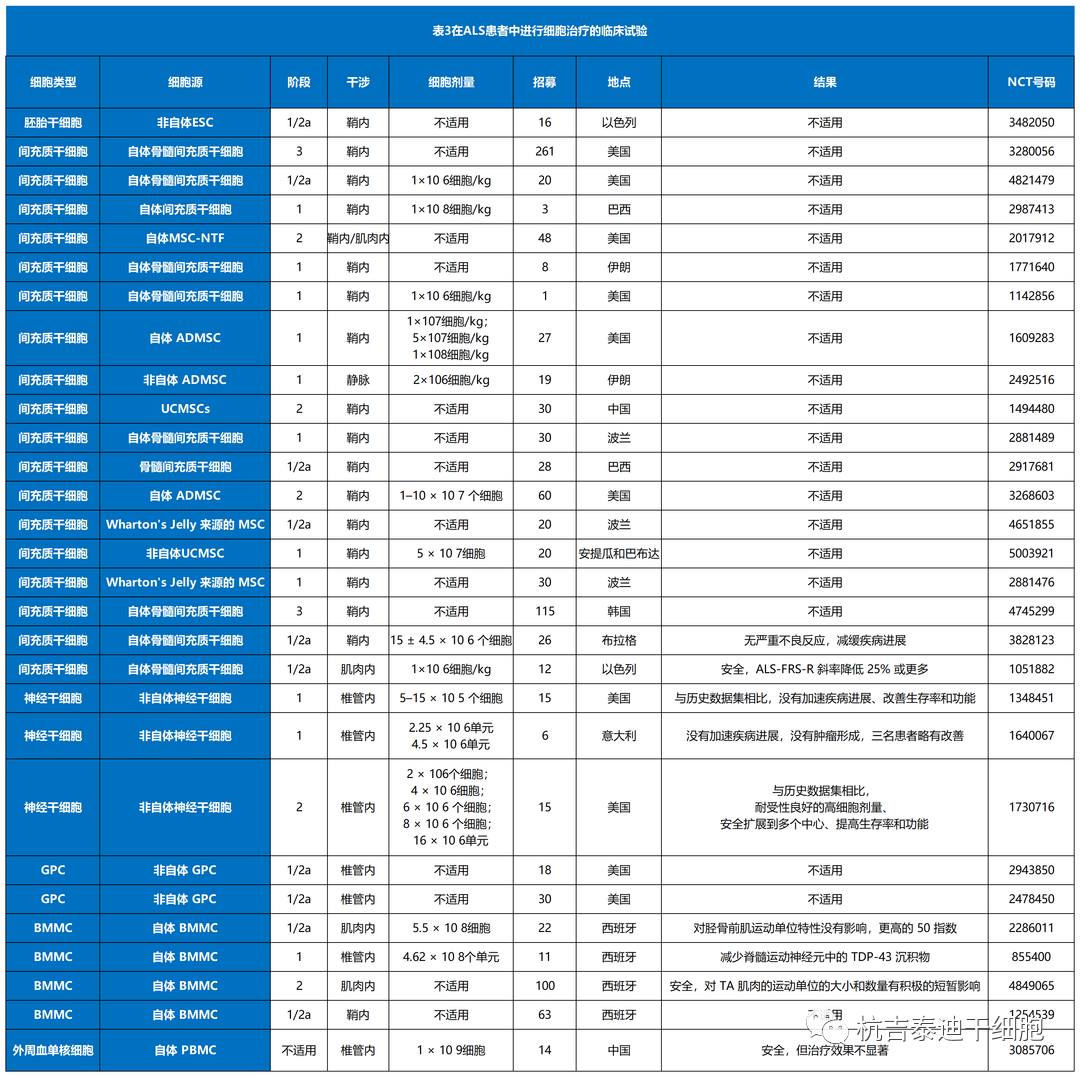
干细胞治疗渐冻症的干细胞类型有哪些
胚胎干细胞治疗渐冻症
胚胎干细胞来源于发育中的囊胚的内细胞团,具有自我更新和多能性的能力;换句话说,它们可以无限期地发育成人体中的任何细胞类型。然而,如此强大的能力是一把双刃剑,因为可塑性不仅允许胚胎干细胞用于人类发育生物学、药物发现和移植治疗等多个科学领域,而且使它们难以控制。因此,胚胎干细胞被认为是治疗渐冻症的潜在干细胞资源。
研究报告了胚胎干细胞可能的治疗益处。细胞为恶化的内源性MN提供的营养支持。除了ESC衍生的MN之外,还研究了ESC衍生的星形胶质细胞。
一项I/IIa期试验招募了16名ALS患者接受人胚胎干细胞衍生的星形胶质细胞治疗(NCT03482050, 2018),针对宿主星形胶质细胞的功能补偿。
诱导多能干细胞治疗渐冻症
诱导多能干细胞极大地改变了干细胞研究的格局。它们具有类似ESC的特性,包括无限扩张和分化成三个胚层的能力。与ESC相比,伦理困境和移植排斥的规避极大地推动了iPSC治疗成为一种有前途的方法的潜力。
几项使用皮肤成纤维细胞衍生的iPSC的临床前研究报告了iPSC的治疗潜力。一项研究将人类iPSC (hiPSC) 衍生的神经干细胞 (NSCs) 移植到脊髓中,发现hiPSC-NSCs可以在ALS微环境中存活并分化成神经元。此外,IT和静脉注射hiPSC-NSCs均可改善ALS疾病表型并延长啮齿动物模型的寿命,且无副作用。
间充质干细胞治疗渐冻症
如今,间充质干细胞被认为是一种很有前途的治疗渐冻症的工具,原因如下:
- 间充质干细胞可以从体细胞组织中有效、安全地获得,并且可以很容易地在体外培养系统中扩增;
- 间充质干细胞可以迁移到损伤组织部位,这种特性称为“归巢”,由趋化因子介导;
- 间充质干细胞可以释放多种生物因子,促进神经组织的维护和修复;
- 间充质干细胞在适当条件下可形成神经元表型;
- 间充质干细胞的伦理问题低于ESCs或胎儿来源的干细胞;
- 自体间充质干细胞可以安全给药,没有免疫排斥的风险;
- 间充质干细胞可以分泌调节微环境的外泌体。
许多临床研究已经检验了间充质干细胞的安全性和有效性。在I期临床研究中,安全性评估显示,没有严重的移植相关不良事件,也没有大脑或脊髓的结构变化,例如肿瘤形成。细胞的重复注射通常用于细胞治疗。例如,重复注射自体骨髓来源的MSC (BM-MSC) 没有显示出明显的不良事件 。
一项在ALS患者中重复鞘内注射BM-MSCs的II期临床试验是安全且耐受性良好的。
最近,一项比较NurOwn®与安慰剂的随机III期对照临床试验也已在ALS患者中完成 (NCT03280056)。结果在主要终点上未达到统计学意义;尽管如此,接受NurOwn®的患者在神经炎症、神经退行性变和神经营养因子支持的脑脊髓生物标志物方面得到了显著改善。尽管该试验不支持细胞疗法对ALS的拟议临床益处,但 NurOwn®仍需进一步研究。
神经干细胞治疗渐冻症
近年来,许多研究都讨论了神经干细胞的治疗益处。由于神经干细胞可以分化为神经元,它们可以替代丢失或受伤的神经元,从而有助于重建运动回路。神经干细胞可以通过分泌神经营养因子来恢复中枢神经系统病变的微环境。调节神经元可塑性增加内源性神经元的存活和再生,促进树突再生,抑制凋亡细胞死亡,增强受损轴突再生。
最后,神经干细胞在CNS中释放免疫调节分子,从而导致CD3+T细胞和CD25+和CD25+/CD62L+Treg细胞增加。神经干细胞可降低活化巨噬细胞的比例,并通过清除细胞外琥珀酸盐与单核吞噬细胞相互作用,从而影响免疫反应并抑制炎症。
已经进行了几项临床试验。第一个FDA批准的I期试验于2009年进行(NCT01348451)。腰椎注射后未发现严重并发症,大部分不良事件可归因于免疫抑制剂的毒性或注射过程本身;这一发现与另一项I期研究 (NCT01640067) 的结果一致。宫颈注射也具有良好的耐受性,而双重靶向组(腰椎和颈椎)显示出疾病进展缓慢。人神经干细胞移植移植可能对ALS早期出现脊柱症状的患者有益。对7名患者的尸检表明,移植的人神经干细胞移植在移植后可以存活长达2.5年,“巢”由注射部位附近的供体细胞组成。
另一项开放标签试验 ( NCT01730716) 表明人神经干细胞移植可以安全地以高剂量注射,并且该程序可以扩展到多个外科中心。与历史对照相比,移植显著提高了修订后的ALS功能评定量表评分,这表明可能的疗效。
总而言之,临床前和临床研究提供了植入框架;随着获得更扎实的知识,神经干细胞移植可能成为治疗渐冻症的主要候选者。
结论和观点
在这篇综述中,我们总结了干细胞疗法治疗渐冻症的临床研究进展,包括多能干细胞ESC和iPSC;多能干细胞,例如MSCs和神经元相关祖细胞,以及MCs。尽管ESCs/iPSCs可以分化成三个胚层,但肿瘤形成风险是临床实践中的主要关注点。相比之下,间充质干细胞、神经元相关祖细胞和MCs因其丰富的营养因子分泌、增强的神经发生、异常的蛋白质聚集体清除和免疫调节而具有调节微环境和神经保护的能力而很有前景。图2)。
总结了目前干细胞治疗渐冻症的临床前研究和临床试验(表1–3)。其中,间充质干细胞占所有细胞类型的绝大部分(图3A)。自2017年和 2021年进行了两项III期研究以来,间充质干细胞具有巨大潜力(图3B)。与间充质干细胞类似,单核细胞是新兴的细胞疗法,一项II期研究正在准备中,而神经前体细胞需要进一步的临床研究。图 3C)。
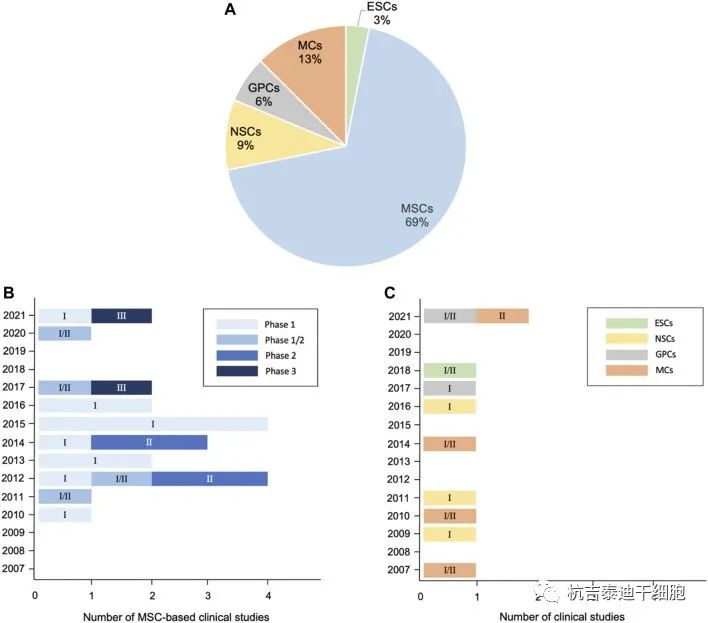
(A)饼图:细胞类型分析。(B)基于MSC的临床阶段应用趋势。(C)基于ESC、神经前体细胞和MC的临床阶段应用趋势。截至2021年10月,已注册32项临床试验,不包括根据Clinicaltrials.gov的暂停、暂时不可用、终止、撤回、可用和不再可用状态的研究。栏中的数字图3B、C标明相应的临床试验阶段。
总的来说,近年来大量出现的临床试验表明,人们对干细胞治疗渐冻症的实际应用越来越感兴趣。尽管大多数试验仍处于早期阶段,但将进行更先进的研究,细胞治疗平台将优化不同干细胞的剂量和类型,以用于未来的渐冻症临床治疗。
参考资料:
Lin TJ, Cheng GC, Wu LY, Lai WY, Ling TY, Kuo YC, Huang YH. Potential of Cellular Therapy for ALS: Current Strategies and Future Prospects. Front Cell Dev Biol. 2022 Mar 16;10:851613. doi: 10.3389/fcell.2022.851613. PMID: 35372346; PMCID: PMC8966507.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号