糖尿病(DM)是一种由遗传、环境和其他因素引起的慢性非传染性疾病。在过去的三十年里,全球糖尿病患者人数增加了一倍多,使其成为全球最重要的公共卫生挑战之一。
勃起功能障碍(DED),定义为无法达到和/或维持足以进行满意性交的勃起,是DM的主要并发症。糖尿病被认为是勃起功能障碍发展的主要危险因素,自1970年代以来,糖尿病与勃起功能障碍发展之间的关联已在动物模型和人类中得到证实。由于其多因素病理生理学以及与血管病变、神经病变和抑郁症相同的成分同时存在,因此越来越多的注意力集中在男性糖尿病患者的勃起功能障碍上。
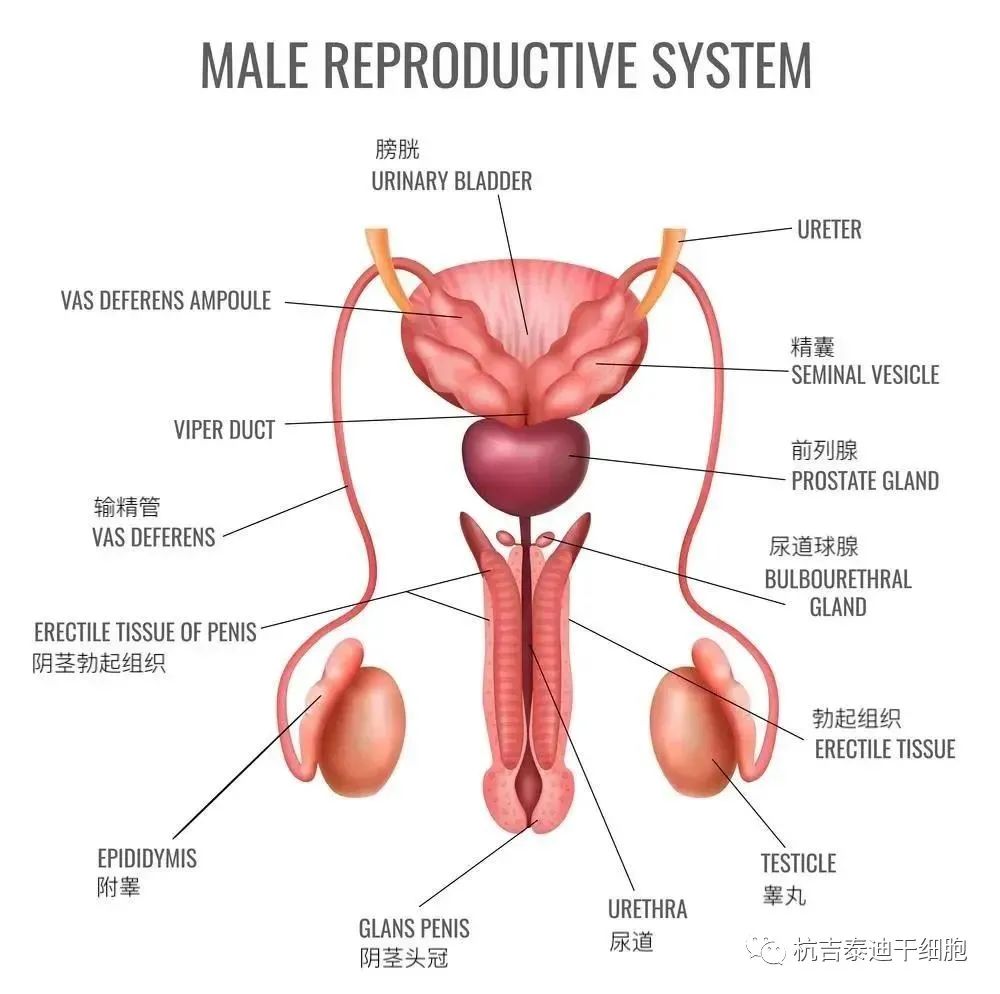
常规临床治疗仍存在局限性:尽管口服磷酸二酯酶5抑制剂 ( PDE5Is ) 是一种成功的一线疗法,但相当一部分男性对口服PDE5Is没有反应。ED的其他常规疗法包括口服药物、海绵体内注射、真空勃起装置和阴茎植入物。然而,由于缺乏有效性和安全性的高质量证据,患者依从性差,治疗效果差,上述治疗方案在临床应用中仍存在争议。近20年来见证了干细胞治疗 (SCT) 的进步,有望成为治疗糖尿病勃起功能障碍 (DED) 的替代选择,并取代目前的常规治疗选择。
干细胞治疗糖尿病性勃起功能障碍潜力及分类
术语“干细胞”包括具有自我更新和分化能力的各种细胞,其中许多可以潜在地用于治疗。除了分化成成熟的组织细胞外,干细胞还可以发挥治疗作用,因为它们具有趋化性、抗炎、再生、血管生成和抗凋亡特性。大量的再生医学研究证明了干细胞的治疗潜力。
干细胞有两种主要类型,胚胎干细胞(ESCs)和成体干细胞(ASCs)。胚胎干细胞来源于植入前胚胎的内细胞团。受限于生物学和医学伦理,ESCs在ED治疗中的临床应用受到限制。ASC 是合乎道德的,更容易从宿主那里获得。因此,来源于患者自身的ASCs近年来受到了研究者的青睐。
目前,许多临床前研究已经使用各种类型的ASCs来证实改善勃起功能的结论,包括骨髓间充质干细胞(BMSCs)、脂肪干细胞(ADSCs)、神经源性干细胞、间充质干细胞(MSCs)和尿源性干细胞(USCs)。它们具有最窄的分化能力和重复分裂的特殊特性,使其成为再生医学治疗用途的有希望的候选者。
2006年,Takahashi和Yamanaka报道了一种将多能ASC重新编程为多能状态的方法。逆转录病毒介导的具有四种转录因子(Oct-3/4、Sox2、KLF4和c-Myc)的小鼠成纤维细胞的转导可以诱导成纤维细胞变为多能性。这种新形式的干细胞被命名为诱导多能干细胞(iPSCs)。一年后,该实验在人体细胞上也取得了成功。iPSCs开辟了干细胞研究的新领域,因为它们可以无限增殖并分化成任何来源的细胞。iPSCs在SCT中绕过了对胚胎的需求,因为它们是从宿主患者自身的细胞中获得的,它们是自体的,不再产生任何免疫排斥的风险 (表格1)。

探究干细胞治疗糖尿病性勃起功能障碍的机制
间充质干细胞的疗法已在DED领域进行了研究。总体目标是修复潜在的海绵体细胞损伤。
Zhang等人探索了脐带间充质干细胞的治疗机制,使用高级糖基化终产物治疗大鼠海绵状内皮细胞以模拟糖尿病环境。然后,将两种细胞共培养以评估USCs在体外的保护作用。最后,他们得出结论,自噬功能障碍与DMED大鼠的海绵状内皮功能和勃起功能障碍有关。此外,USCs可以上调海绵内皮细胞的自噬活性,从而改善内皮海绵功能障碍,最终有望改善糖尿病引起的勃起功能障碍。这些基于干细胞的临床前研究强调了干细胞治疗后DED动物勃起功能的改善,并解释了其潜在机制。
干细胞还可通过过度表达神经营养因子、趋化因子、抗炎分子、血管生成因子和其他有助于组织恢复和内源性修复的分子来充当治疗剂。各种研究证实,修饰的干细胞可以修复DED中导致内皮功能障碍的受损信号通路。
临床试验证明:干细胞移植可改善糖尿病患者勃起功能障碍
临床试验一:脐血干细胞海绵体内移植治疗糖尿病性阳痿7例初报

巴克等人在研究中招募了7名2型DED患者,他们均对药物治疗不敏感超过6个月,需要等待阴茎假体植入。研究人员将1.5×1.7的人脐带血细胞注入海绵体内,并记录了他们的国际勃起功能指数,性接触概况、全球评估问题、勃起日记、血糖日记和用药剂量。结果显示,6名患者中有3名在1个月后恢复了晨勃反应,3个月后上升至5名。随访6个月,2例患者在口服PDE5i的前提下完成性生活并达到性高潮。9个月后,所有5名患者都感到性欲增加。在整个随访过程中,两名患者退出植入阴茎假体,其中四人恢复了勃起功能。并且没有报道SCT的副作用。
临床试验二:确定用胎盘源性干细胞治疗人类勃起功能障碍的可行性

征收等将胎盘间充质干细胞治疗ED患者注射到8名未口服药物的 ED患者中,并在6周、3个月和6个月时进行MSC治疗,以评估峰值收缩速度 (PSV)、舒张末期根据国际勃起功能指数问卷调查速度、阴茎伸展长度、阴茎宽度和勃起功能状态。结果显示,在6周时,两名患者出现自发并保持勃起;3个月时,一名患者可以自发勃起。患者3个月和6个月的平均PSV值显著高于治疗前。
临床试验三:骨髓单核细胞海绵体内注射治疗根治性前列腺切除术后勃起功能障碍临床试验

在1期临床试验中,12例前列腺癌根治术后ED患者(药物治疗失败)给予BMSCsICI4次,BMSCs注射剂量逐渐增加(2×107、2×108、1×109 , 和2×109 )。结果显示,12名患者中有9名在口服PDE5i的前提下勃起功能有明显改善。结果发现,随着注射剂量的增加,自发勃起的发生率增加,该研究未报告注射后出现任何严重的不良反应。
在同一研究的II期临床试验中,又招募了6名患者,最佳剂量(1×109) 在第1阶段确定的BMSCs被注射。结果显示,18例患者IIEF-5指数中的性满意度评分和勃起功能评分较治疗前均有明显改善。
临床试验四:间充质干细胞注射治疗糖尿病患者勃起功能障碍中的安全性和潜在治疗效果临床试验

2018年,在Demour等人进行的I期临床试验中,人类骨髓间充质干细胞首次用于治疗DED。他们包括四名治疗失败的DED患者,并将从患者身上提取的BMSC注射到阴茎海绵中两次。注射后立即和24小时后评估患者的耐受性。1年后通过IIEF-5和EHS评分评价有效性,2年后评价安全性。结果显示,所有患者手术耐受性良好,无明显不良反应。随访12个月后,患者IIEF-15、EHS、勃起功能、性欲、性满意度、总体满意度评分均较治疗前明显改善。
讨论
从目前多项干细胞移植治疗器质性ED的临床前研究和少量临床研究来看,干细胞移植的有效性和安全性相当可观,也被认为是未来治疗器质性ED非常有前景的方法。
目前,只有9项临床试验报告干细胞治疗男性ED的有效性和安全性,试验样本量不到100例。根据每项研究的结果,患者的整体阴茎血流动力学和勃起功能评分均得到显着改善。未观察到重大不良反应。
经过多年的多次临床前试验探索,目前干细胞移植治疗器质性ED的机制已得到明确。关于干细胞移植治疗ED的主要机制。首先,干细胞移植可以修复和替代海绵状神经。干细胞分化为海绵状神经细胞、平滑肌细胞和内皮细胞。其次,干细胞移植通过EV的旁分泌作用提供阴茎组织支持,提供促血管生成、抗炎、抗凋亡和抗纤维化特性。研究表明,旁分泌修复细胞因子的释放是一种独立于干细胞分化为不同细胞类型的内源机制。
综上所述
勃起功能障碍是糖尿病常见的并发症之一,糖尿病相关的代谢紊乱引起大量的并发症,包括心脑血管疾病、视网膜病变、肾病和创伤愈合不良等。降低了患者的生活质量,并可能导致死亡。干细胞通过释放可溶性生长因子和细胞因子来刺激新血管的形成和调节炎症,为糖尿病并发症提供了很有前途的方法。
参考资料:Luo DS, Li YQ, Deng ZQ, Liu GH. Progress and prospect of stem cell therapy for diabetic erectile dysfunction. World J Diabetes. 2021 Dec 15;12(12):2000-2010. doi: 10.4239/wjd.v12.i12.2000. PMID: 35047115; PMCID: PMC8696650.




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号