1型糖尿病 (T1DM) 和2型糖尿病 (T2DM) 是广泛流行的代谢性疾病,病理学各异。T1DM表现为胰腺β细胞的自身免疫性破坏,导致胰岛素分泌减少。T2DM源于胰岛素抵抗状态,导致高血糖和β细胞质量减少。这两种疾病都会导致严重的健康后果。尽管T1DM和T2DM的全球患病率都在增加,但这两种疾病的医学治愈方法仍然没有定论。
最近,间充质干细胞 (MSC) 已被提议作为一种可能的治疗方法。
在这篇综述中,我们解释了间充质干细胞背后的分子机制及其治疗1型糖尿病和2型糖尿病的潜在能力。
我们描述了间充质干细胞分化为胰岛素分泌细胞和再生胰腺β细胞的能力,并评估了它们在调节免疫系统中的作用。最后,我们评估了当前关于间充质干细胞移植在1型糖尿病和2型糖尿病中的临床应用的文献。尽管结果良好,但研究设计和分析对间充质干细胞治疗1型糖尿病的有效性提出了质疑。相反,文献中一致证明的积极代谢效应为间充质干细胞治疗2型糖尿病带来了希望,至少在短期内如此。

1型糖尿病和2型糖尿病的病理生理学
糖尿病于100多年前就已被认识,而早在1936年,人们就已证实了“胰岛素抵抗”或2型糖尿病与自身免疫性病因1型糖尿病之间的区别机制。此后,人们提出了许多致病因素。这些遗传、环境和代谢影响的核心是胰腺β细胞及其与人体胰岛素敏感组织(肝脏、骨骼肌和脂肪组织)的关系。在健康状态下,胰腺β细胞与这些组织之间存在反馈回路,即β细胞分泌胰岛素,胰岛素随后增加脂肪组织和骨骼肌对葡萄糖、氨基酸和脂肪酸的吸收,同时抑制肝脏的糖异生。这些胰岛素敏感组织随后向β细胞反馈,以防止胰岛素分泌过多,尽管发生这种情况的机制仍有待完全阐明。
在2型糖尿病中,多种因素(包括生活方式行为(即饮食、身体活动)和遗传因素(如与脂肪代谢和β细胞功能有关的基因))会导致这种反馈回路中断。这通常被称为“胰岛素抵抗”状态,这些组织表现出葡萄糖摄取能力下降,使人易患高血糖症。此外,由于无法充分摄取葡萄糖,脂肪组织、骨骼肌和肝细胞无法对胰腺β细胞施加负反馈,导致胰岛素持续分泌和潜在的高胰岛素血症状态。最后,随着这些病理状态的持续,β细胞质量会由于各种潜在的、尚未完全确定的因素而减少。β细胞数量的减少加上无法替换,导致β细胞周转不平衡。因此,人们认为,在有葡萄糖的情况下分泌胰岛素的能力下降是从糖耐量受损进展到2型糖尿病的原因。
前述胰岛素敏感组织和胰腺β细胞之间反馈回路的功能障碍并不是1型糖尿病的生物学基础。相反,诱发原因是胰腺无法分泌胰岛素。
1型糖尿病是一种自身免疫性疾病,由多种遗传和环境因素导致缺乏自我耐受性,并最终导致胰腺β细胞的破坏。在众多被认为会影响这种疾病的免疫介质中,调节性T (Treg) 细胞被研究作为一种重要的促成因素。在健康状态下,Treg细胞会抑制免疫系统,防止过度激活和自身免疫损伤。因此,Treg基因突变会导致这些细胞发挥其通常调节功能的能力下降,并且至少是造成1型糖尿病中免疫介导损伤的部分原因。因此,这种免疫系统功能障碍——当与环境因素和其他随机事件相结合时——被认为会导致胰腺β细胞的破坏,从而导致人体分泌胰岛素和/或监测血糖稳态的能力。
目前针对1型糖尿病 (T1DM) 和2型糖尿病 (T2DM) 的治疗选择
由于1型糖尿病和2型糖尿病的发病机制不同,这两种代谢紊乱的治疗方法也不同。
如前所述,在患2型糖尿病之前,通常会出现逐渐恶化的胰岛素抵抗和糖耐量受损状态。因此,对于那些被确诊为空腹血糖 (FPG) 升高或患有肥胖症等常见合并症的人,非常重视通过改变生活方式来防止病情恶化。根据患者的不同情况(例如体征/症状、禁忌症和费用),不同的药物通常会与治疗性生活方式干预相结合。一些针对胃肠系统的药物旨在减缓胃排空,从而降低葡萄糖吸收率,而另一些药物则增强十二指肠激素,以促进葡萄糖吸收。肾脏是2型糖尿病治疗的另一个治疗目标,因为它具有进行糖异生的能力并在葡萄糖重吸收中发挥作用。对于严重胰岛素抵抗的患者,外源性胰岛素和旨在增强胰岛素敏感性的药物已被证明是有效的治疗选择。
由于1型糖尿病的代谢障碍不是细胞对胰岛素的抵抗,而是胰岛素的缺失,因此药物干预是必要的,并且总是涉及外源性胰岛素的给药。在研究环境中,其他药物(如免疫抑制剂)已被用作辅助治疗选择。
令人担忧的是,上述疗法和药物都无法完全阻止1型糖尿病和2型糖尿病中观察到的胰腺β细胞破坏。此外,这些药物可能与严重的副作用有关,包括急性胰腺炎和心血管事件。因此,一种能够防止β细胞质量减少的安全有效的治疗方法具有重要的临床意义。
由于间充质干细胞不仅能够阻止胰腺β细胞的破坏,而且还能够再生这些细胞,因此可能为1型糖尿病和2型糖尿病提供一种潜在的治愈方法。
间充质干细胞治疗糖尿病的作用机制
分化为胰岛素产生细胞
间充质干细胞具有发育可塑性,可形成胰腺内分泌表型。这被认为是间充质干细胞用于治疗糖尿病的主要机制。研究表明,来自不同组织和器官的间充质干细胞,如骨髓、脂肪组织和脐带中的沃顿果冻,都能分化成类似小岛的细胞,或功能性IPC。
胰岛β细胞的再生
除了IPC分化外,MSC还通过分泌各种细胞因子和生长因子帮助再生内源性胰岛β细胞。Si等人发现,在糖尿病大鼠模型中,MSC的输注可显著再生内源性β细胞。
免疫调节和抗凋亡作用:保护内源性细胞
除了再生内源性胰腺胰岛β细胞之外,MSC还能通过免疫调节保护这些细胞。这种免疫调节被认为是MSC发挥抗糖尿病作用的主要机制 – 通过免疫调节,MSC可防止1型糖尿病患者中产生胰岛素的胰腺β细胞的自身免疫性破坏。MSC的免疫调节特性包括:
(1) 抑制T细胞对有丝分裂原和抗原刺激的反应,
(2) 抑制树突状细胞分化和
(3) 以剂量依赖性方式抑制B细胞增殖。综上所述,这些研究表明MSC的免疫抑制作用可有效降低自身免疫反应,从而避免导致胰腺β细胞破坏。
MSCs的抗氧化和抗凋亡作用进一步增强了对内源性胰岛细胞的保护。因此,人们认为MSCs的免疫调节特性对于使用MSCs治疗的T1DM和T2DM患者所观察到的恢复效果至关重要。
间充质干细胞移植治疗1型糖尿病的临床应用
这里我们总结了四项利用自体人类干细胞治疗1型糖尿病的临床试验的结果(表格1)。不同的患者种族、试验选择标准和治疗持续时间可能导致结果的异质性。
尽管如此,根据四个主要标准——空腹血糖水平 (FPG)、C肽、糖化血红蛋白 (HbA1c) 和每日胰岛素注射剂量,一些治疗方法比其他治疗方法产生了更多的治疗效果。一般来说,使用MSCs或其他形式的干细胞似乎耐受性良好,尽管一些研究显示结果不太理想。
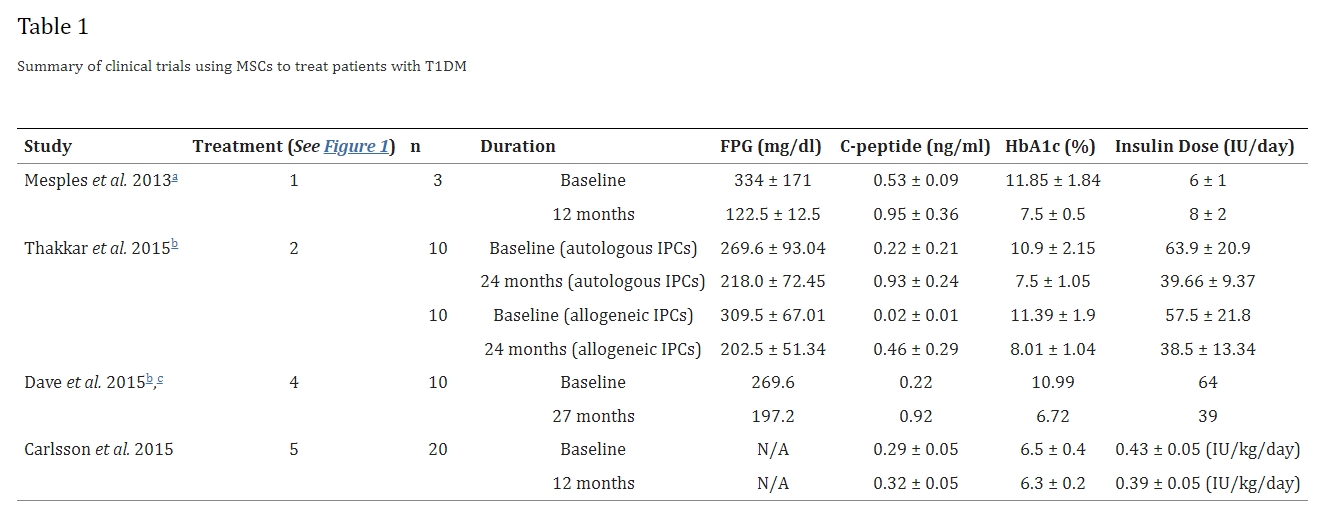
大多数研究没有进行统计学显著性检验来比较随访值与基线值。然而,这些研究的总体值在随访中均有所改善。Carlsson等人在2015年没有发现基线值与12个月随访值之间存在任何统计学显著差异。Zhao等人发现值有显著改善,包括C肽增加、HbA1c降低和每日胰岛素剂量降低。
间充质干细胞治疗1型糖尿病的临床案例一:
在 Mesples等人进行的一项研究中。接受治疗的患者注射了集落刺激因子 (G-CSF) (图1),并在第五天抽取骨髓移植至第六肝段。接受治疗的两名患者的胰岛细胞抗体 (ICA)、谷氨酸脱羧酶自身抗体 (GAD) 和抗胰岛素抗体水平均呈负值,同时C肽水平升高,血糖和糖化血红蛋白降低,提示这些患者的胰岛素分泌增加,高血糖得到改善。该研究的成功表明自体骨髓干细胞 (BMSCs) 治疗是有效的。
他们的研究结果表明,BMSCs可逆转抗胰腺胰岛抗体的产生和作用,并显著提高C肽浓度。然而,该研究可能不具有普遍性,因为样本量较小,限制了研究人员充分评估数据和证明统计学意义的能力 (表格1)。
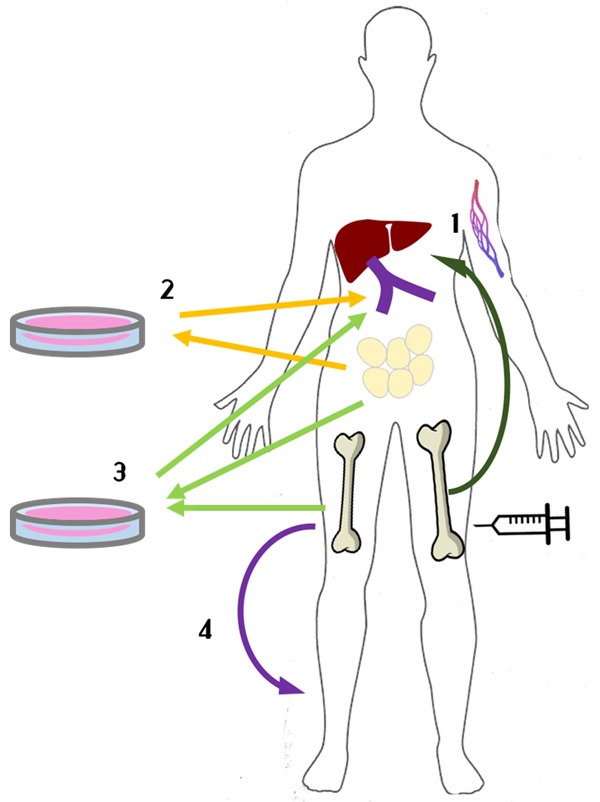
1)用G-CSFa和BMSCs植入肝脏,在体内刺激骨髓。
2) 来自脂肪组织(自体或同种异体)的MSCs分化为IPC并植入门脉/甲状腺循环。
3) 来自脂肪组织的MSC衍生IPC和来自BM的HSC的混合物注入门脉循环。
4) 静脉输注BM-MSCs。
间充质干细胞治疗1型糖尿病的临床案例二:
Thakker等人提出的研究表明,从人类脂肪组织中分离的MSCs也表现出缓解糖尿病引起的高血糖的能力(图1)。根据CD45–/73+/90+标记物筛选出MSCs,并进一步分化为IPCs,这通过Pax6、Isl-1和Ipf-1等免疫荧光标记物得到证实。来自MSCs的IPC被注射到门脉/甲状腺循环中。
注射MSCs后,血糖和HbA1c水平显著降低,C 肽水平升高,外源性胰岛素需求减少。输注细胞中有0.81%为CD34 +,远高于Mesples等人的研究(>0.22%)。鉴于Thakker等人的研究显示出更好的治疗效果,有理由认为,更高比例的CD34+IPC或更强的造血干细胞可能有助于缓解T1DM的预后。虽然这项研究显示了两种治疗方法之间的显著差异,但由于没有将结果与基线值进行比较,因此缺乏统计学意义来证明MSC治疗的疗效(表格1)。
间充质干细胞治疗1型糖尿病的临床案例三:
另一组研究人员采用了与 Thakker等人提出的方法类似的方法,结果显示MSC衍生的IPC和自体造血干细胞 (HSC) 共同输注到门脉循环后,糖尿病临床标志物显著改善(图1) 。经过27个月的治疗,10名患者中的每一位均在所有四项标准(FPG、C 肽、HbA1c和每日胰岛素剂量)中均显着改善,且无明显副作用。值得注意的是,GAD抗体从331.1IU/mL降低到123IU/mL表明β细胞损伤减少,进一步支持了HSC可以减缓β细胞破坏,从而增加胰岛素分泌的观点。总之,一组在使用IPC和BMSC治疗T1DM方面显示出看似积极的结果。然而,作者没有进行统计检验来证明他们的结果明显优于基线或报告标准误差数据(表格1)。
间充质干细胞移植治疗2型糖尿病的临床应用
如前所述,1型糖尿病的主要诱因是胰腺β细胞的自身免疫性破坏,因此MSC移植和分化为IPC是一种合理的治疗方法。相反,人们认为2型糖尿病的主要诱因是胰岛素敏感组织无法正确响应胰岛素。乍一看,这似乎意味着MSC移植和分化为IPC对该人群的临床意义不大。然而,如前所述,2型糖尿病通常会导致胰腺β细胞质量下降和功能下降。这种破坏究竟如何或何时发生仍是一个有争议的话题。因此,利用间充质干细胞移植治疗和可能治愈2型糖尿病不仅是合理的,而且是有可能的。
间充质干细胞治疗2型糖尿病的临床案例一:
干细胞移植治疗2型糖尿病的疗效的临床证明,始于2009年Bhansali等人发表的一项临床试验。他们的研究小组利用自体BMSC,将其移植到10名2型糖尿病患者的胰腺中,并在基线和6个月的随访中再次进行测量。他们发现7/10名患者能够将胰岛素需求量减少≥50%,在这7名患者中,有2名能够完全停止使用胰岛素(分别在BMSC治疗后7天和41天)。作为一个群体,所有患者的每日胰岛素需求量和HbA1c均显着减少,同时空腹C肽水平显着增加(表2)。
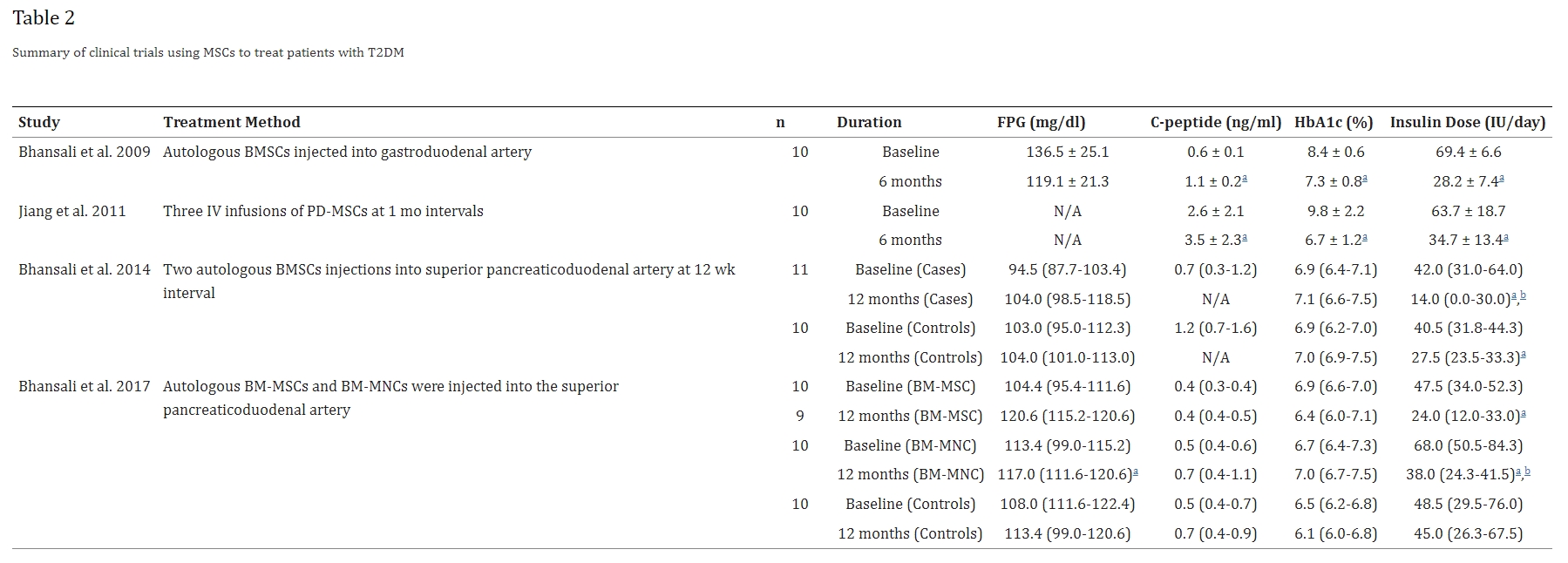
回顾的研究表明,接受MSC治疗的2型糖尿病患者的病情有显著改善,尤其是每日所需胰岛素剂量显著降低。Bhansali等人2009年和Jiang等人2011年使用他们独特的MSC治疗方法,C肽、HbA1c水平和胰岛素剂量显著改善。Bhansali等人2014年显示每日胰岛素需求显著改善。Bhansali等人2017年显示,接受BM-MSC和BM-MNC治疗的患者的每日胰岛素需求显著减少,此外接受BM-MNC治疗的患者的FPG水平显著增加(阴性结果)。
间充质干细胞治疗2型糖尿病的临床案例二:
2011年,Jiang等人在一项I期临床试验中尝试了类似的T2DM治疗方法,利用胎盘来源的MSCs (PD-MSCs) 治疗了总共10名T2DM患者。他们没有使用单剂量,而是每隔1个月给患者进行三次静脉输注PD-MSCs,并在最后一次输注后3个月进行随访检测。他们的研究结果证实了Bhansali等人的研究结果:所有接受PD-MSCs治疗的患者的每日胰岛素和HbA1c值均显著降低,C肽水平显著升高(表2)。
间充质干细胞移植治疗2型糖尿病的临床案例三:
Bhansali及其同事于2014年进行了另一项临床试验。他们设计了一项前瞻性、随机、单盲和安慰剂对照研究,以评估BMSC疗法对2型糖尿病患者的疗效和安全性。共有21名2型糖尿病患者(11名病例组,10名对照组)参与了这项研究,病例组接受了自体BMSC注射,而对照组接受了安慰剂注射。随访测量分别在第3、6和12个月进行,所有21名患者均进行了12个月的随访。病例组和对照组在胰岛素剂量和C肽水平方面有显著改善。此外,尽管病例组的胰岛素需求减少了≥50%,但HbA1c值仍保持在7%以下(表2)。
间充质干细胞移植治疗2型糖尿病的临床案例四:
2017年又出现了另一项随机安慰剂对照研究,这次研究了自体BM-MSC与骨髓来源的单核细胞 (BM-MNC,实际上是HSC以及其他单核淋巴细胞) 相比的功效。10名患者接受了BM-MSC,10名患者接受了 BM-MNC,10名患者作为对照组并接受了假手术。所有患者均进行了12个月的随访。在12个月的随访中,BM-MSC组仅显示每日胰岛素需求显着减少。相反,BM-MNC组在12个月的随访中显示胰岛素需求显着减少,刺激的C肽显着增加。与BM-MSC组相比,BM-MNC组的每日胰岛素需求减少幅度更大。此外,BM-MSC组在治疗后显示胰岛素敏感性增强(表2)。
这些研究明确表明,间充质干细胞移植确实有助于减轻2型糖尿病给身体带来的部分代谢负担。这些研究已证明这些治疗方法能够显著降低患者的每日胰岛素需求量、降低HbA1c水平并提高循环C肽水平。
结论
间充质干细胞在治疗1型糖尿病和2型糖尿病方面的治疗潜力已得到广泛研究。由于间充质干细胞具有内源性胰腺β细胞修复能力以及免疫调节特性,因此间充质干细胞疗法已被证明可在大鼠、小鼠和人类试验中改善高血糖症。本文,我们重点关注使用间充质干细胞治疗1型糖尿病和2型糖尿病患者的人类临床试验,以评估此类疗法的疗效。
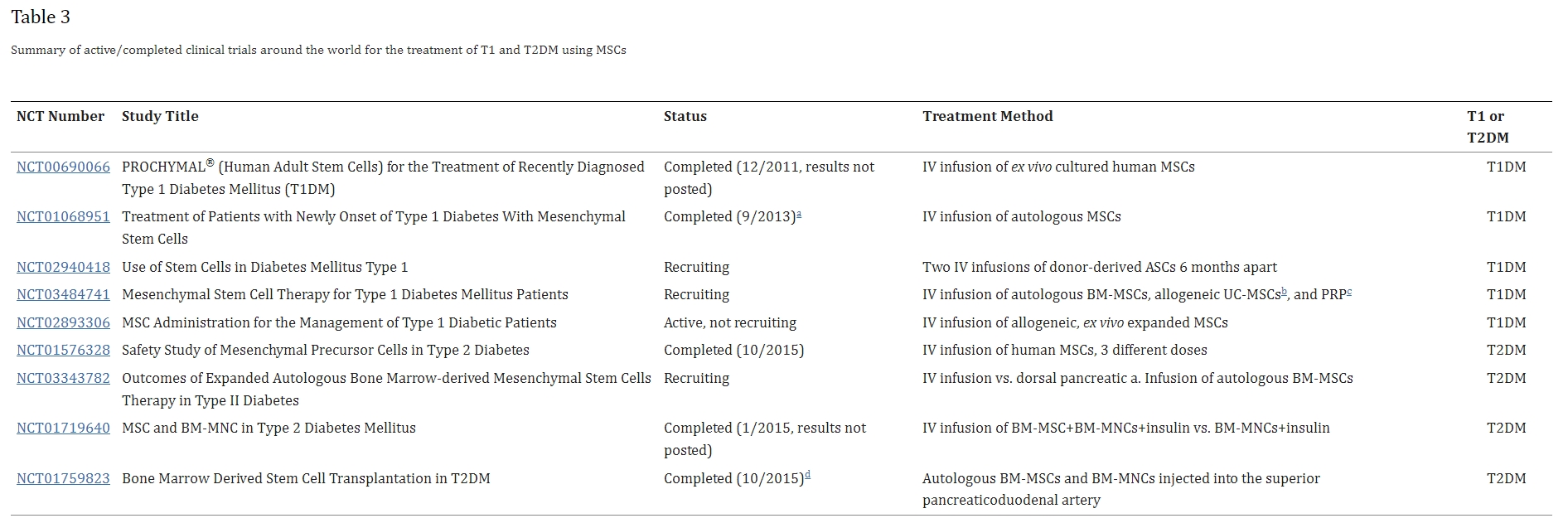
表3总结了已完成或正在进行的使用间充质干细胞治疗1型糖尿病和2型糖尿病的临床试验。鉴于此类研究的数量,该领域正在发展,我们希望在治疗和潜在治愈这些高发病率疾病方面取得更大进展。
除了这些临床试验之外,还需要进一步进行动物研究,以继续阐明间充质干细胞发挥其抗糖尿病作用的具体机制,并进一步研究用间充质干细胞治疗的1型糖尿病动物模型中看到的积极结果与本文介绍的临床试验之间的差距。增强对这些机制的了解将使间充质干细胞移植用于治疗糖尿病更加具体地改进。
此外,随着CRISPR等新技术的出现,现在可以对干细胞进行精确的修改和操作,结合对间充质干细胞在糖尿病治疗中的治疗机制的更好理解,也可能改善临床结果并为1型糖尿病和2型糖尿病提供潜在的治愈方法。
参考资料:Cho J, D’Antuono M, Glicksman M, Wang J, Jonklaas J. A review of clinical trials: mesenchymal stem cell transplant therapy in type 1 and type 2 diabetes mellitus. Am J Stem Cells. 2018 Oct 1;7(4):82-93. PMID: 30510843; PMCID: PMC6261870.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号