概述:使用源自人类多能干细胞的胰岛样胰岛素生成细胞的干细胞疗法有可能让1型糖尿病患者退出胰岛素治疗。然而,使用干细胞疗法治疗1型糖尿病存在一些问题。
在这篇综述中,我们将重点关注以下主题:
(1) 干细胞来源的胰岛细胞自体移植过程中的自身免疫反应,
(2) 干细胞疗法与胰岛素注射疗法的比较,
(3)干细胞衍生胰岛细胞上的胰岛微环境,
(4) 干细胞衍生胰岛细胞移植的成本效益。基于这些不同的观点,我们将讨论对1型糖尿病患者进行干细胞治疗所需的条件。
简介
产生胰岛素的β细胞遭到破坏是1型糖尿病 (T1D) 的主要病理生理学特征。可以通过每日多次外源性胰岛素注射或通过泵连续输注胰岛素来降低血糖水平。
然而,由于外源性胰岛素不通过肝脏,胰岛素无法调节肝脏葡萄糖水平,导致T1D患者的血糖控制不稳定。血糖控制不足会导致T1D患者出现长期并发症。传感器增强型胰岛素泵治疗和整个胰腺或胰岛的移植治疗可能是补偿β细胞功能和控制血糖水平的有用策略。

虽然胰腺移植可使血糖水平正常化和胰岛素戒断的发生率很高,但它需要技术上困难的手术,并且可能有多种术后并发症,包括门静脉血栓形成。胰腺移植也提高了生活质量;然而,供体数量有限,需要进行免疫抑制治疗。因此,胰腺和胰岛的移植都存在与供体短缺、免疫抑制治疗和移植物排斥相关的问题。
干细胞疗法作为一种可以应对供体短缺的方法,一种从人类多能干细胞(hPSCs)包括诱导多能干细胞(iPSCs)或胚胎干细胞(ESCs)制备胰岛样细胞并将其应用于移植的治疗策略可以考虑。
在过去的15年中,已经建立了诱导人类干细胞向胰腺内分泌细胞分化的基本方法,该细胞在胚胎发生过程中从定形内胚层形成为胰腺内胚层,然后分化为胰腺祖细胞,产量可达20– 40%胰岛素+胰岛样细胞。
干细胞衍生的假胰岛移植有可能改善糖尿病啮齿动物的胰岛素分泌。然而,干细胞来源的胰岛细胞移植后免疫反应和β细胞功能的变化如何进展仍不清楚。此外,与传统糖尿病疗法相比,还必须考虑β细胞或假胰岛干细胞疗法的成本效益。

hPSC衍生的胰岛类器官的活细胞成像(左)和免疫荧光(右)。
GFP在胰岛素启动子下表达。细胞用胰岛素(绿色)、胰高血糖素(红色)和DAPI(蓝色)抗体染色。
在这篇综述中,我们将重点关注在对1型糖尿病患者进行干细胞治疗之前应考虑的问题,例如自身免疫反应、与传统胰岛素治疗的比较、微环境和成本。
干细胞治疗1型糖尿病中的自身免疫反应
人类多能干细胞衍生的胰岛样细胞的自体移植有可能在没有免疫排斥的情况下提供血糖控制。人们认为诱导多能干细胞的自体移植不会引起移植物排斥,因为这些诱导多能干细胞来自患者自身。
来自hPSC的胰岛移植改善了糖尿病小鼠的高血糖症。因此,诱导多能干细胞的自体移植被认为是有用的,但需要大量的时间和成本来培养细胞并促进它们分化为产生胰岛素的β细胞。
人类白细胞抗原(HLA)可区分外来抗原并引发免疫反应。HLAII类在树突状细胞等抗原呈递细胞上表达,并将抗原呈递给辅助性T细胞,从而引发抗原特异性免疫反应。II类基因显示与T1D的关联最强,DR和DQ基因形成的单倍型参与T1D的疾病易感性。
据报道,使用间充质干细胞 (MSC) 的移植疗法也很有用,一项临床试验表明,间充质干细胞移植改善了1型糖尿病患者的血糖控制。另一方面,迄今为止,还没有临床试验检验过来自诱导多能干细胞、ESC或MSC的SC胰岛细胞的使用。
预防SC胰岛细胞移植的移植物排斥是一个重要问题。山口等。报道了自体移植研究,其中小鼠PSC衍生的胰岛细胞被移植到患有STZ诱导的糖尿病的小鼠的肾囊中。在该报告中,移植后的前5天需要进行免疫抑制治疗。即使在停用免疫抑制药物后,SC胰岛仍能在370天内持续改善糖尿病小鼠的血糖水平,使其处于正常范围内。
基因修饰方法可能有助于保护SC胰岛细胞免受免疫反应。造血干细胞中HLA-A的缺失改善了免疫功能低下小鼠的植入和造血功能。基于这些报告,不仅关注胰腺β细胞而且关注T1D患者免疫细胞的研究对于促进使用诱导多能干细胞治疗糖尿病的策略非常重要(图2)。

即使是SC胰岛的自体移植也有可能被排斥。因此,需要进一步了解 T1D 中免疫反应的病理生理学。此外,需要避免免疫反应的策略。
干细胞疗法与胰岛素注射疗法的比较
T1D的特点是由于胰岛β细胞被破坏(主要由自身免疫机制引起)而导致的胰岛素缺乏,从而需要终身注射胰岛素,造成慢性高血糖。
目前,胰岛素泵有助于改善血糖水平的管理。有人提出了时间范围(TIR)的概念,作为血糖控制的目标范围,一般成人T1D或T2D患者的推荐范围是一天中至少70%的时间血糖水平在70-180mg/dL之内。使用连续血糖监测(CGM)或冲洗血糖监测(FGM)和具有预测性低血糖暂停(PLGS)功能的胰岛素泵进行血糖监测,有助于更好地维持血糖水平。传感器增强泵(SAP)疗法是CGM和胰岛素泵的结合,被认为是一个人工胰腺,因为胰岛素的用量可以根据CGM的值来调整。
此外,β细胞替代疗法也有望成为治疗1型糖尿病的一种有前景的方法,以实现不注射胰岛素的糖尿病治疗目标。β细胞替代包括胰腺、胰岛或SC-胰岛细胞的移植。在本章中,我们想比较一下干细胞-胰岛细胞和人工胰腺的移植(表1)。
| / | 干细胞-胰岛细胞移植 | 自动胰岛素输送系统 |
|---|---|---|
| 优点 | 免于注射胰岛素 | 无免疫抑制 |
| 改进的范围内时间 | 改进的范围内时间 | |
| 缺点 | 免疫抑制的风险 | 维护复杂 |
| 癌变风险 | 根据饮食调整剂量 | |
| 胰岛素不足的风险 | 低血糖、DKA 或 HHS 的风险 | |
| 再移植的风险 | 局部皮肤问题 |
干细胞疗法
干细胞治疗1型糖尿病患者的两个主要优势是不需要胰岛素注射和血糖监测,并且可以改善TIR。在20mM高葡萄糖刺激下,从T1D患者产生的iPSCs衍生胰岛显示胰岛素分泌类似于从非糖尿病患者产生的iPSCs衍生胰岛,表明葡萄糖依赖性胰岛素分泌(2.0±0.4vs1.9±0.3mIU/103个细胞)。
金等人从T1D和T2D受试者中生成iPSC衍生的胰岛素分泌细胞,并将它们与健康对照者的细胞进行比较,每个衍生细胞分泌的胰岛素取决于血糖水平。每次进食都要测量血糖和注射胰岛素对1型糖尿病患者来说是一种生理和心理负担,但干细胞疗法可以让1型糖尿病患者摆脱血糖监测和胰岛素注射。T1D衍生的iPSC与健康受试者的iPSC之间的胰岛素分泌也没有显着差异。
因此,针对β细胞的干细胞疗法可能会改善葡萄糖刺激的胰岛素分泌,从而更好地控制TIR并降低低血糖的发生率。
人工胰腺
人工胰腺的优点是它可以改善TIR并减少低血糖的发生频率,而无需免疫抑制。组织或细胞移植后,需要给予免疫抑制药物以防止免疫排斥反应,这可能伴随着易感染、肾毒性和骨髓抑制等不良反应。
人工胰腺可以将TIR提高到与内源性胰腺相同的程度。SAP疗法结合胰岛素泵和CGM在临床实践中广泛用于治疗1型糖尿病。
使用人造胰腺有三个缺点。
第一个缺点是所需的复杂维护。例如,SAP疗法是一种人工胰腺,需要定期更换CGM和胰岛素输液器的传感器。
其次,存在低血糖和糖尿病酮症酸中毒(DKA)的风险。人工胰腺需要T1D患者根据他们的饮食调整施用的胰岛素,如果患者不小心施用了过多的胰岛素,就有发生低血糖的风险。胰岛素泵的其他问题包括设备故障,例如胰岛素插管堵塞,这会中断胰岛素输注,导致急性高血糖并发症,例如DKA和高渗性高血糖综合征 (HHS)。
第三个缺点是局部皮肤问题的发生,例如脂肪萎缩、脂肪肥大、湿疹和伤口。根据Berg等人的说法,皮肤问题增加了儿科(每人80美元)和成人(每人40美元)患者。
人工胰腺的出现为1型糖尿病患者带来了许多好处,包括改善TIR和减少低血糖的发生,但它尚未消除胰岛素注射和血糖监测的需要。
胰岛微环境对干细胞衍生的胰岛细胞的影响
在正确的分化阶段加入特定的因子,可以从hPSCs产生功能性的小鼠,这些小鼠在葡萄糖的作用下分泌胰岛素。然而,这些SC-小鼠的胰岛素分泌能力较低,与本地人类小鼠相比,SC-小鼠的成熟度仍然较低(例如,它们缺乏尿皮质素3、MAF A和SIX3的表达)。
正在进行的一项针对T1D患者的SC-胰岛移植临床试验(NCT02239354)的结果将为我们提供更多关于移植功能维持的信息。据报道,胰岛微环境和胰腺内分泌细胞之间的相互作用对β细胞的成熟、功能和存活起着关键作用。胰岛微环境(也被称为胰岛生态位)由内分泌细胞(α-细胞、δ-细胞、PP-细胞或ε-细胞)、胰岛细胞、导管细胞、间质基质细胞、内皮细胞、常驻巨噬细胞和细胞外基质组成。此外,丰富的胰岛血管网络和胰岛与交感神经或副交感神经之间的相互作用也存在。这种微环境是移植胰岛血管再通的先决条件;
总结,胰岛微环境与β细胞功能和存活有关。一些成分更适合促进β细胞(例如MSC和内皮细胞)的功能成熟和存活,但对其他细胞或微环境的成分知之甚少(图3)。
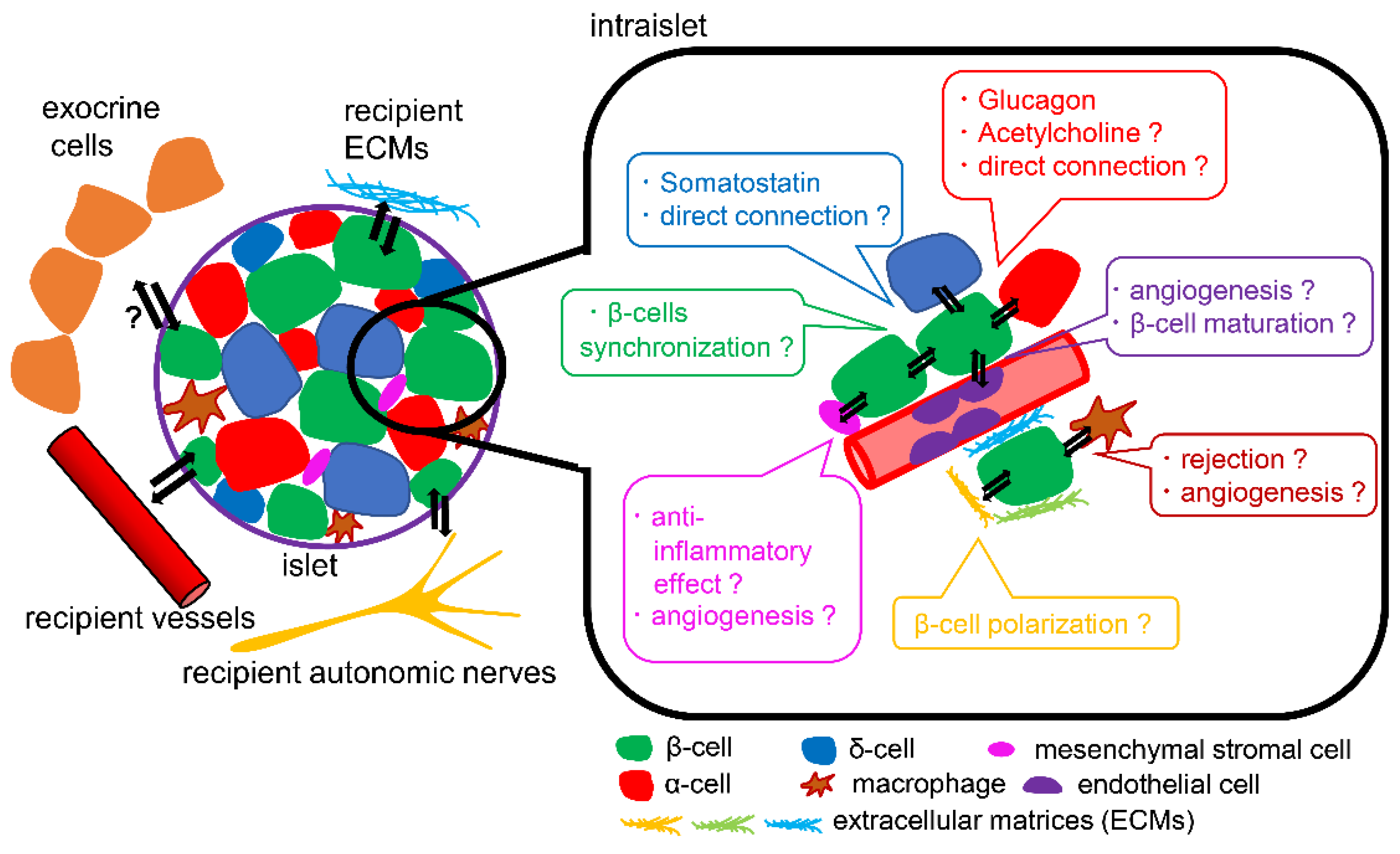
β细胞与α细胞、δ细胞、内皮细胞、间充质基质细胞、巨噬细胞和ECM的相互作用会影响β细胞的功能和存活。移植的hPSC衍生胰岛与移植的人类胰岛之间与微环境相互作用的差异仍不清楚。
干细胞来源的胰岛细胞移植治疗1型糖尿病的成本效益
全球有超过4.63亿糖尿病患者,治疗并发症和改善高血糖相关的医疗保健费用巨大。T1D的治疗包括胰岛素强化治疗 (IIT)、胰岛素泵治疗、胰腺移植和胰岛移植。胰腺或胰岛移植能够调节血糖水平不稳定的T1D患者的血糖水平。
重要的是,这些治疗不仅可以改善患者的生活质量,还可以降低终生医疗保健成本。另一方面,胰腺或胰岛移植有一些缺点,例如缺乏尸体胰腺和胰岛的供体以及需要施用免疫抑制药物。
SC-胰岛细胞移植可以缓解这种供体不足;然而,胰腺β细胞的生产非常昂贵,可能会阻碍与SC胰岛细胞相关的终生医疗保健成本的降低。本章将提供有关SC胰岛细胞移植成本的最新发现(表2)。
| 来源/国家 | 研究人群 | 时间跨度 | 干预和比较 | 每增加一个 QALY | 结果 |
|---|---|---|---|---|---|
| Wallner 等人,2018 年(加拿大) | 平均年龄47岁,成人低血糖不自觉 | 62.5岁 | 干预:尸体胰岛细胞移植 对照:强化胰岛素治疗 | $150,006 | 在每QALY100,000美元的支付意愿 (WTP) 阈值下,胰岛细胞移植的成本效益概率为 0.5% 。 |
| Banderias 等人,2019 年(美国) | 年龄在18-35 岁之间,低血糖意识不足 | 20年 | 干预:干细胞来源的胰岛细胞移植 对照:强化胰岛素治疗 | $249,740 | 当考虑每QALY高达150,000美元的 WTP 时,胰岛细胞移植对3.4%的患者具有成本效益。 |
T1D作为一种胰岛素依赖性疾病,每年的医疗费用为1337亿美元,总收入损失被计算为2892亿美元。从另一个角度来看,2017年,美国使用胰岛素的患者每年支付9601美元的医疗费用。由于血糖控制不稳定,T1D患者还面临着相关并发症的高风险,如截肢、失明和肾衰竭。如果移植能够自主控制血糖,这些手术可以防止与糖尿病有关的并发症,并减少终身医疗费用。
胰岛移植已在几个国家得到批准。胰岛移植的费用估计为13,872美元。2012年,Cooper-Jones, Ford等人报告了一项成本效益研究,表明对于高风险的T1D患者,9至10年后,胰岛移植比胰岛素治疗更具成本效益。
此外,估计胰岛移植在20年内每个病人要花费519,000美元,而胰岛素治疗在20年内每个病人要花费663,000美元。根据这项研究,胰岛移植使平均寿命增加了3.3年,但移植的费用非常高,成本效益远远超过了加拿大保险公司的支付意愿标准。虽然有一些报告讨论了遗体胰岛移植的成本,但重要的是减少移植的数量和免疫抑制药物的成本。
如果不需要免疫抑制药物,就可以减少胰岛移植的医疗费用。避免使用免疫抑制药物的一个方法是通过人类iPSCs衍生的胰岛细胞的自体移植。一份关于这种移植的成本效益分析报告称,与IIT相比,通过防止移植后8年的并发症,可以实现成本效益。
讨论
干细胞治疗1型糖尿病被认为是一种有吸引力的治疗策略,有可能使T1D患者的胰岛素治疗退出。此外,使用iPSCs衍生的胰岛细胞进行自体移植,预计有可能在不需要免疫抑制治疗的情况下治疗T1D患者。
总之,使用诱导多能干细胞的研究预计将有助于推进1型糖尿病的治疗。
参考资料:Inoue R、Nishiyama K、Li J、Miyashita D、Ono M、Terauchi Y、Shirakawa J. 干细胞疗法治疗 1 型糖尿病的可行性和适用性。细胞。2021;10(7):1589。https://doi.org/10.3390/cells10071589。
提示:本文内容来自网络用户投稿,仅供参考,不做为诊断依据,任何关于疾病的建议都不能替代执业医师的面对面诊断。最终以医生诊断为准,不代表本站同意其说法,请谨慎参阅,本站不承担由此引起的任何法律责任。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号