肾脏疾病是世界范围内的主要健康问题。尽管药物治疗取得了进展,但它们只能减缓肾脏疾病的进展。因此,人们开始探索利用干细胞进行肾脏再生的潜在策略。再生策略有两个不同的方向,利用干细胞进行全肾重新制造和干细胞治疗。全肾重新制造策略包括:
- 1)脱细胞支架技术,
- 2)基于工程技术的3D生物打印,
- 3)肾脏类器官制造,
- 4)囊胚嵌合技术,
- 5)器官发生微环境方法。
同时,干细胞治疗策略包括
- 1)注射干细胞,包括间充质干细胞、肾元祖细胞、成体肾干细胞和多谱系分化应激细胞,
- 2)注射这些干细胞分泌的保护因子,包括生长因子、趋化因子和含有microRNA、mRNA和蛋白质的细胞外囊泡。
在过去的几十年里,这些策略取得了显著的进步。
本文,我们回顾了利用干细胞治疗肾病进行肾脏再生的潜在策略的最新进展,以及未来可能在临床应用中面临的挑战。
介绍
全球范围内慢性肾脏病 (CKD) 患者的发病率持续上升,CKD已成为日益严重的健康负担。终末期肾脏病 (ESKD) 需要肾脏替代治疗,包括血液透析、腹膜透析和肾移植。2010年,有261万人接受了透析或肾移植,预计到2030年这一数字将翻一番。由于供体数量少且移植后需服用免疫抑制药物,只有少数人能够接受肾移植。
同时,透析治疗并不能完全取代肾脏的作用,导致患者生活质量下降,并因心血管疾病等并发症导致预后不良。尽管近年来技术取得了进展,包括可穿戴人工肾脏和生物人工肾小管辅助装置 (RAD),但仍然难以补偿整个肾脏功能。因此,建立肾脏再生疗法非常重要,而使用干细胞的策略可能是实现这一目标的潜在选择之一。
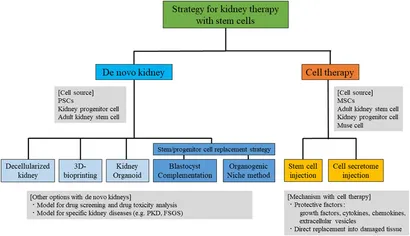
利用干细胞进行肾脏再生的策略有两个方向:“重建”和“修复”。其中“重建”策略包括利用干细胞从头制造肾脏并通过移植进行替换,“修复”策略包括诱导原生肾脏修复系统(图1)。
从头肾脏制造的策略有几种,包括
- 1)脱细胞支架技术,
- 2)基于工程技术的3D生物打印,
- 3)肾脏类器官制造,
- 4)囊胚互补技术,
- 5)器官发生生态位法。
诱导原生肾脏修复系统包括
- 1)注射干细胞,例如间充质干细胞(MSCs)、肾元祖细胞(NPCs)、成体肾干细胞和多谱系分化应激(Muse)细胞,
- 2)注射干细胞分泌的保护因子。在过去的几十年里,两个方向都取得了显著的循序渐进的发展。
在这里,我们总结了目前利用干细胞进行肾脏再生的潜在策略,以及它们在肾脏疾病患者临床应用中面临的挑战。
新肾制造的方法有哪些?
脱细胞肾脏
脱细胞策略是从头制造肾脏的选项之一。该方法使用洗涤剂,例如十二烷基硫酸钠 (SDS) 和 Triton X-100,去除整个器官中的细胞,然后注入特定细胞(例如干细胞),使其分化为成熟细胞并与细胞外基质 (ECM) 一起植入脱细胞支架中。这一概念首先应用于心脏,然后应用于肺、肝脏和肾脏。
对于肾脏,将小鼠胚胎干细胞 (ES) 注射到大鼠脱细胞肾脏中,在那里观察到分化为ES细胞衍生的血管、肾小球和肾小管。另一个研究小组也应用了这一概念,将小鼠ES细胞接种到来自肾动脉的去细胞大鼠肾脏上,结果显示接种细胞在血管系统和肾小球毛细血管中分布均匀,没有凋亡迹象。还通过将来自肾动脉的人脐静脉内皮细胞 (HUVEC) 注射到去细胞大鼠肾脏和来自输尿管的大鼠新生肾细胞中,研究了再细胞化肾脏的尿液产生情况。
3D生物打印
3D生物打印的应用是从头制造肾脏的另一种方法。生物打印是一种技术,涉及逐层精确沉积生物墨水(通常是含有细胞的水凝胶)或生物材料墨水(不含细胞),以构建复杂的组织或器官。有几篇关于耳朵等组织构建的报道,但尚未报道从头制造整个肾脏。整个肾脏的构建面临多项挑战,包括细胞类型和生物材料的选择,以及肾脏结构的复杂性及其细胞类型的多样性。尽管如此,据报道取得了重要的一步,即利用 3D 生物打印技术生成了血管化结构网络以及近端上皮细胞。
同一研究小组进一步开发了一种具有内皮和上皮通道的双通道肾脏模型。他们使用明胶和纤维蛋白的混合物作为ECM材料,并在生物打印后对细胞进行后接种。
此外,该产品可能对体外药物肾毒性测试和疾病建模有用。3D生物打印技术还用于肾脏类器官模型,以进行高通量药物肾毒性分析,其中iPS细胞衍生的类器官是通过3D生物打印方法生产的,具有更高的可重复性和更短的时间范围。
类器官
利用自组织技术从多能干细胞 (PSC) 构建肾脏器官是一项重大挑战。一般而言,从PSC进行自组织诱导应基于对肾脏发育的了解。
肾单位由三种类型的祖细胞组成:NPC、输尿管芽 (UB) 和基质祖细胞。NPC通过间质-上皮转化形成管状上皮细胞和肾小球。UB通过多个分支分化为集合管。基质祖细胞分化为间质细胞。多个研究小组已报道通过从PSC分化诱导NPC。Taguchi等人通过多个步骤结合多种生长因子从iPS细胞中建立了NPC。此外,通过将NPC与小鼠胚胎的脊髓一起培养,他们成功创建了包含3D肾小球和肾小管的肾脏结构。其他研究小组也建立了使用PSC衍生的NPC构建3D肾元(包括肾小球和肾小管)的方案。
然而,通过将类器官移植到小鼠体内,构建的类器官连接了宿主的血管网络。尽管取得了这些逐步的发展,但仍存在一些挑战。
- 首先,目前报道的类器官尺寸太小,无法产生足够的尿液来维持体内平衡。
- 其次,需要与大血管进行运输。有几个研究小组报道了通过将肾类器官移植到肾包膜下来构建血管系统,但这些方法都相当简单。尽管如此,最近一项利用微流控芯片上的流动创建肾类器官的研究显示,血管网络扩张,足细胞和肾小管区室成熟,细胞极性和成体基因表达水平更高,表明肾类器官中血管系统的进展。
- 第三,仍然需要从 PSC 建立基质祖细胞。
- 第四,类器官的成熟仍然是一个重要问题。Taguchi等人。报道称,所制备的肾类器官在7天培养中与E15.5肾脏相当。除了通过PSC制造外,另有报道称可从成体肾干细胞产生肾类器官。
通过在Matrigel中培养具有多种生长因子的成体肾干细胞簇,细胞簇分化为肾小球、小管上皮细胞和集合管,表明存在具有分化为NPC和UB谱系能力的成体肾干细胞。
总之,类器官技术可能有助于探索特定疾病和/或治疗机制,以及治疗药物筛选。
囊胚互补
囊胚补充法是将PSC植入部分组织/器官缺陷的动物未分化生殖细胞中,并从植入的PSC中衍生出缺陷部分的方法。通过将此策略应用于Pdx1缺陷的胰腺生成障碍啮齿动物模型,创建了PSC衍生的胰腺。建立的胰腺主要来自植入的PSC。此策略也应用于肾脏。通过将ES细胞注射到缺乏Sall1基因(该基因对于后肾间充质发育至关重要)的小鼠囊胚中,Usui等人成功实现了PSC衍生的肾脏的生产;肾小球和肾小管细胞来自 ES 细胞,而其他集合管和血管细胞则来自宿主。
此外,还报道了跨物种产生。Goto等人在跨物种实验中将小鼠来源的ES细胞移植到Sall1缺陷大鼠体内,成功制备了小鼠PSC来源的肾脏,其中肾小球和肾小管上皮完全由小鼠PSC来源的细胞组成,输尿管-膀胱连接处形成正常,这表明可以在异种宿主中使用该策略,例如使用人PSC。
器官生态位方法
器官微环境法利用后期胚胎肾脏的器官微环境,应用囊胚补充的概念,将器官祖细胞植入器官发育的部位和时间,并在生长中的胎儿系统中进行离体培养以分化为器官。
干细胞治疗
干细胞给药
干细胞注射是诱导再生机制的一种选择。植入干细胞有两种机制:通过迁移、分化和植入到受损部位替换受损组织,以及植入干细胞的旁分泌作用。
干细胞注射的优势在于其归巢效应;植入的干细胞迁移到受损组织并可能有助于局部旁分泌作用。
有大量已发表的报告表明MSC静脉注射对啮齿动物急性肾损伤 (AKI) 模型(由药物或缺血/再灌注 (I/R) 损伤引起)和CKD模型(例如5/6肾切除术、糖尿病肾病和单侧输尿管梗阻)的再生作用。虽然据报道MSC衍生细胞植入是一种直接替代机制,但证据表明,主要的营养作用可归因于旁分泌作用。MSC可从多种组织中获得,包括骨髓、脂肪组织和脐带。尽管MSC来源可能存在异质性,但据报道,每种MSC都具有肾保护作用。
关于肾脏特异性干细胞,Kitamura等人建立了成体肾脏干细胞,通过替换受损组织,施用这些细胞可改善 I/R诱发的AKI模型中的肾功能。此外,有几份报告证明,在药物或I/R诱发的急性肾损伤和5/6肾切除术诱发的慢性肾病中,PSC衍生的NPC治疗可以保留肾功能。
此外,据报道,Muse细胞(可从各种器官收集的非致瘤性内源性多能样干细胞)的治疗可通过归巢到受损肾小球并分化为肾小球细胞来改善阿霉素诱导的局灶节段性肾小球硬化模型。
总之,干细胞治疗肾病可能通过直接和间接机制对急性肾损伤和慢性肾病均具有治疗潜力。
干细胞分泌组的管理
由于干细胞治疗的旁分泌作用可能在干细胞治疗中发挥主要作用,因此干细胞的分泌组和再生机制备受关注。MSCs的分泌组以及再生机制已得到很好的总结。先前的报告显示,旁分泌机制包括细胞增殖、抑制细胞凋亡、调节炎症、血管生成和肾小管细胞去分化。人们认为,各种因素协同作用来介导这些机制。
MSCs可能分泌生长因子、趋化因子和含有微小RNA (miRNA)、mRNA 和蛋白质的细胞外囊泡 (EVs) 。作为生长因子,MSC分泌肝细胞生长因子 (HGF)、表皮生长因子样生长因子 (EGF)、碱性成纤维细胞生长因子 (bFGF) 和血管内皮生长因子 (VEGF),据报道,这些因子均具有肾脏保护作用。
此外,越来越多的证据表明,来自MSC的含有EV的miRNA是干细胞治疗中的重要贡献者。来自MSC的营养性miRNA包括miR-21、miR-199、Let-7家族和miR-30,它们可能通过与3′-UTR结合而沉默其靶基因。还有报道称,这些分泌蛋白组可能受到多种刺激的修饰,包括缺氧、炎症刺激和改变的培养条件。由于EVs可以作为一种天然的药物输送系统,将多种因子高稳定性地运送到远处的器官,因此利用特定的miRNAs来治疗来自干细胞的EVs可能是另一个有前途的选择。
结论
这里,我们总结了干细胞应用的两个方向“重建”和“修复”。对于这两种方法,临床应用仍存在一些挑战。关于“重建”方法,需要血管侵入肾脏、肾脏大小足以产生尿液、诱导不显示尿蛋白的足细胞以及通过尿液流入肾小管并重新吸收重要物质的详细机制产生肾脏。
由于结构和功能的复杂性,肾脏的重建与其他器官相比很困难。然而,考虑到过去几十年的快速发展,“重建”技术在未来可能是可能的。
关于“修复”,我们仍然需要阐明肾脏的再生机制,以便我们可以使用干细胞或干细胞介导的分泌体激活这些机制。尽管存在这些挑战,但使用干细胞进行再生治疗是一种有前途的肾保护策略。
参考资料:Tsuji K, Kitamura S and Wada J (2022) Potential Strategies for Kidney Regeneration With Stem Cells: An Overview. Front. Cell Dev. Biol. 10:892356. doi: 10.3389/fcell.2022.892356
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号