移植源自人类多能干细胞的神经元前体,是治疗与神经元缺失有关的神经系统疾病(如神经退行性疾病、脑外伤和中风)的一种前景广阔的疗法。
将干细胞分化出的移植神经元与宿主受损神经元回路进行功能整合,一直是大脑修复细胞治疗策略的一大挑战。尽管其他细胞类型或机制可提供适度的临床改善,但受损区域的神经元替代和重建对最佳和长期恢复至关重要。
这一过程包括三个重要方面(图1):(1)产生代表受损脑区的特定神经元亚型;(2)形成从宿主大脑到移植神经元的功能性传入突触连接;(3)建立从移植细胞到宿主大脑特定区域的功能性传出突触联系。
我们之前的研究表明,人皮源性神经前体移植到缺血性中风后大鼠的躯体感觉皮层后,会形成与位于大脑该区域的内源性神经元相似的传入突触连接模式,并与适当宿主大脑结构的神经元形成传出连接。最近使用动物模型进行的其他研究进一步证明了移植细胞与受损宿主大脑回路的功能整合能力。有趣的是,将人类大脑皮层神经元移植到成人大脑皮层的体外器官型培养物上,也证明了宿主和移植细胞之间建立了传入和传出突触。然而,功能恢复和新神经元融入大脑网络背后的机制仍存在一些未知之处,近日,巴塞罗那大学生物医学系、神经科学研究所将对此进行讨论(图1)。
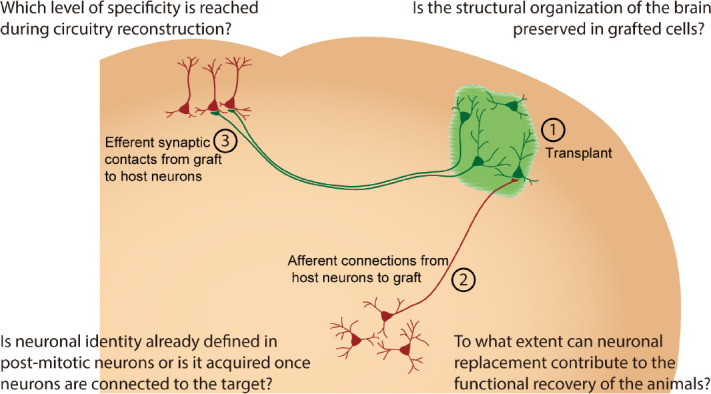
电路重建过程中会达到哪种特异性水平?
要回答这个问题,我们必须考虑到移植神经元的区域特性对于正确重建神经元网络至关重要。在这方面,细胞特性决定了从移植神经元到不同宿主脑区的传出连接的形成,这一过程需要几个月的时间,因为人类神经元的成熟期比小鼠神经元长,有时新形成的轴突需要长时间,例如从一个半球到另一个半球。相比之下,通过使用基于狂犬病毒的单突触追踪,可以在早期时间点(移植后6-8周)观察到宿主神经元(包括非相邻脑区的神经元)与移植细胞之间形成广泛的传入连接。因此,这些突触接触很可能是在靶神经元死亡后作为重新连接而建立的,或作为先前存在的轴突的次级分支而建立的。在这种情况下,早期传入模式将由移植位置决定,而与移植细胞产生的神经元亚型无关。有趣的是,在大鼠纹状体异位移植多巴胺能神经祖细胞会导致不同的传入连接模式,这与将相同细胞移植到黑质时观察到的模式不同。
值得注意的是,神经祖细胞的全身注射(即静脉注射或动脉内注射)导致对脑实质的浸润有限,因此整合能力较低。因此,移植位置和移植细胞的区域特性将决定电路重建过程中达到的特异性程度。同样,移植神经元的成熟阶段和神经元命运的决定也会影响细胞的存活率和突触连接性:过于成熟的神经元会降低存活率,而过早的祖细胞则会导致异质性细胞产物和非特异性功能重建(如帕金森病人移植人类胎儿神经元后产生的5-羟色胺能神经元)。
移植细胞是否保留了大脑的结构组织?
这个问题对于大脑皮层等显示不同神经亚型特定组织的区域尤为重要。位于大脑皮层特定层的神经元在功能上是特化的,其特征是表达特定层的转录因子。例如,Tbr1是一种在大脑皮层第5层和第6层的皮质丘脑投射神经元中高度表达的转录因子,在含有皮质有缘祖细胞的移植物深层区域,Tbr1的表达量是无缘细胞的3倍。因此,如果成体大脑中新形成的神经元的组织是由局部线索引导的,那么具有适当身份的细胞将更有效地响应这些信号,从而更紧密地重建大脑皮层结构。从功能角度来看,有研究表明,移植到成年小鼠受损视觉皮层的小鼠胎儿神经祖细胞能整合到宿主网络中,并表现出刺激选择性反应。这些移植细胞接收来自宿主神经元的传入输入,包括拓扑组织的基因-皮层连接。使用人类细胞也获得了类似的结果。
然而,目前仍不清楚新形成的神经元如何准确复制受损区域原有的空间组织。在这方面,最新的空间分辨率全转录组分析技术有助于回答这个问题。从技术角度看,区分移植细胞和宿主细胞的能力也很重要。如果移植细胞与受体动物来自同一物种(异体移植),则需要使用荧光报告物、PKH染料或纳米粒子进行标记。
神经元特性是在有丝分裂后的神经元中已经确定,还是在神经元与目标连接后才获得?
最近发表的使用电子显微镜和基于狂犬病毒的单突触追踪的结果表明,在大鼠中风模型中移植的人类祖细胞衍生的神经元向大脑对侧半球发出投射,并与宿主神经元建立突触联系。此外,经胼胝体连接的移植细胞表达皮质胼胝体投射神经元标记,表明这一通路的特定重建。然而,目前还不清楚移植的神经元是在建立突触连接之前获得其命运,还是突触连接的形成决定了新形成神经元的命运。在第一种情况下,承诺神经元拥有引导轴突到达适当目标的信息;而在第二种情况下,轴突的定向伸长遵循共同的内源性信号(如白质通路),一旦形成突触连接,与目标神经元的交流将决定移植神经元的命运。
众所周知,新形成的神经元的特性在大脑发育的早期阶段就已确立,并由发育信号的精确时空调控决定。然而,这些发育信号在多大程度上仍然存在于成人大脑中还不清楚,必须进一步探索。重要的是,移植部位的微环境,包括细胞因子的类型和免疫反应的细胞元素,会从脑损伤的急性阶段到慢性阶段发生变化,从而对移植细胞的成熟和整合起到不同的作用。
神经元替代能在多大程度上促进动物的功能恢复?
要评估细胞疗法对脑组织功能恢复的贡献,最有说服力和最优雅的策略是使用光遗传学或化学遗传学(即使用专门设计的受体由专门设计的药物激活)使移植的神经元沉默。据我们所知,只有两篇文章采用了这种策略。第一篇文章将表达光门控氯化物泵halorhodopsin的人类胚胎干细胞衍生间脑多巴胺能神经元移植到帕金森病小鼠模型的纹状体中。通过走廊测试,作者发现移植动物从病变引起的帕金森运动障碍中恢复过来,并且光诱导的移植活性沉默可逆地重新引入了小鼠的侧向行为。
另一篇文章介绍了在中风大鼠模型中获得的结果。在这项工作中,人类诱导多能干细胞衍生的皮层神经元移植到影响躯体感觉和运动皮层的缺血性病灶附近,促进了动物的功能恢复。表达卤化表皮素的移植神经元的光遗传沉默导致大鼠在移植6个月后出现双侧功能障碍(圆筒测试)。与帕金森氏症模型的研究结果相反,第二项研究并未发现在抑制移植细胞的神经元活动时,未处理组的大鼠会出现侧向功能障碍。这种差异可能是由于移植细胞在帕金森病小鼠模型中的异位位置(多巴胺能神经元天然位于黑质,而移植细胞被置于纹状体)。这很可能会阻碍原有回路的重建,受损动物纹状体中多巴胺的释放只能依赖于移植神经元的活动。
在第二项研究中,移植神经元的正确位置会促进特定传入和传出突触连接的产生,从而导致原有回路的重建,尤其是跨胼胝体的沟通。这可能解释了在大鼠中风模型中,沉默移植神经元后观察到的双侧功能障碍。正如使用注射了表达卤化核糖蛋白慢病毒的完整大鼠所显示的那样,沉默其中一个半球的躯体感觉区和邻近运动区的皮质神经元会导致双侧功能障碍,这表明当抑制功能整合在大脑这一区域的神经元的活动时,这应该是预期的结果。这两项研究表明,移植神经元衍生活动有助于动物模型的长期功能恢复,为临床应用的开发开辟了新途径。
总之,动物模型研究的最新进展提供了支持性证据,证明新的神经元可以替代受伤后死亡的细胞,这是大脑功能长期最佳恢复的一个关键方面。未来的研究应着眼于了解干细胞疗法修复脑损伤的有益作用背后的机制。尽管这种方法存在一些明显的局限性,但干细胞治疗的临床应用正在成为现实。基础研究与临床研究之间的相互协作,应有助于克服干细胞疗法在临床实践中目前的局限性和未来的挑战。
参考资料:Tornero D. Neuronal circuitry reconstruction after stem cell therapy in damaged brain. Neural Regeneration Research. 2022 Sep;17(9):1959-1960. DOI: 10.4103/1673-5374.335145. PMID: 35142674; PMCID: PMC8848622.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号