在过去20年中,干细胞疗法被认为是治疗多种疾病,特别是神经退行性疾病的一种很有前景的选择。干细胞通过分泌神经营养因子、细胞置换、激活内源性干细胞和减少神经炎症等不同机制,发挥保护神经和神经退行性疾病的作用。人们提出了多种干细胞来源,用于移植和修复受损组织。
近几十年来,深入研究的重点是妊娠干细胞,认为它是细胞移植疗法的新资源。本综述介绍了最近临床前/临床应用妊娠干细胞治疗神经退行性疾病的最新情况,包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病(HD)和肌萎缩侧索硬化症(ALS)[1]。不过,应鼓励开展进一步的研究,以便将这种前景广阔的治疗方法应用于临床。
什么是神经退行性疾病:神经退行性疾病(NDDs)是指一组以大脑或脊髓神经元缺失为特征的病理状态,通常与认知、精神和运动障碍等多种临床表现相关。
NDD可由急性或慢性事件引发。急性病例,如缺血性中风和创伤性脑或脊髓损伤,是由创伤事件导致损伤部位神经元缺失引起的。另一方面,慢性病例与细胞群的选择性丧失有关,如帕金森病(PD)中的多巴胺能神经元和肌萎缩性脊髓侧索硬化症(ALS)中的运动神经元。
大多数神经退行性疾病的特征是折叠错误的蛋白质(理化性质改变的蛋白质)堆积,这是疾病的标志。蛋白质积聚的例子有:
- (i) a-突触核蛋白(a-syn),这是一种14kDa的小蛋白,由SNCA基因编码,是路易体沉积物的主要成分,存在于帕金森病患者的大脑中;
- (ii) 在ALS患者的运动神经元中观察到的43kDa的转录反应DNA结合蛋白的泛素化蛋白质内含物;
- (iii) Aβ斑块(由39至42-aa长的Aβ肽片段组成)和神经纤维缠结(由 tau 寡聚体形成),在阿尔茨海默病(AD)中,tau寡聚体分别存在于神经元外部和内部;
- (iv) 突变的亨廷顿蛋白聚集体,据报道这是亨廷顿氏病(HD)的主要特征之一,存在于整个大脑神经细胞的细胞质和细胞核中;
- (v) 朊病毒蛋白PrPSc累积,这是一种由位于20号染色体上的PrP(PRNP)基因编码的253氨基酸蛋白,也显示出一种突触沉积模式,在所谓的 “朊病毒疾病 “中被检测到;
- (vi) FET蛋白,这是一个蛋白家族,包括FUS(融合肉瘤蛋白)、EWSR(尤文肉瘤RNA结合蛋白1)和TAF15(TATA结合蛋白相关因子,TAF15),据报道,在神经系统疾病(如额颞叶变性(FTLD)和渐冻人性脊髓侧索硬化症)中会形成细胞质聚集体。
遗憾的是,迄今为止还没有成功治疗神经退行性疾病的方法。由于神经退行性疾病的病理生理学性质复杂,可能需要一种多模式治疗方法。其目的是补充丢失的神经细胞,清除有毒沉积物,并保证为这些细胞的存活和可塑性提供必要的安全环境。近年来,干细胞疗法被认为是治疗神经退行性疾病的一种新的潜在治疗策略。
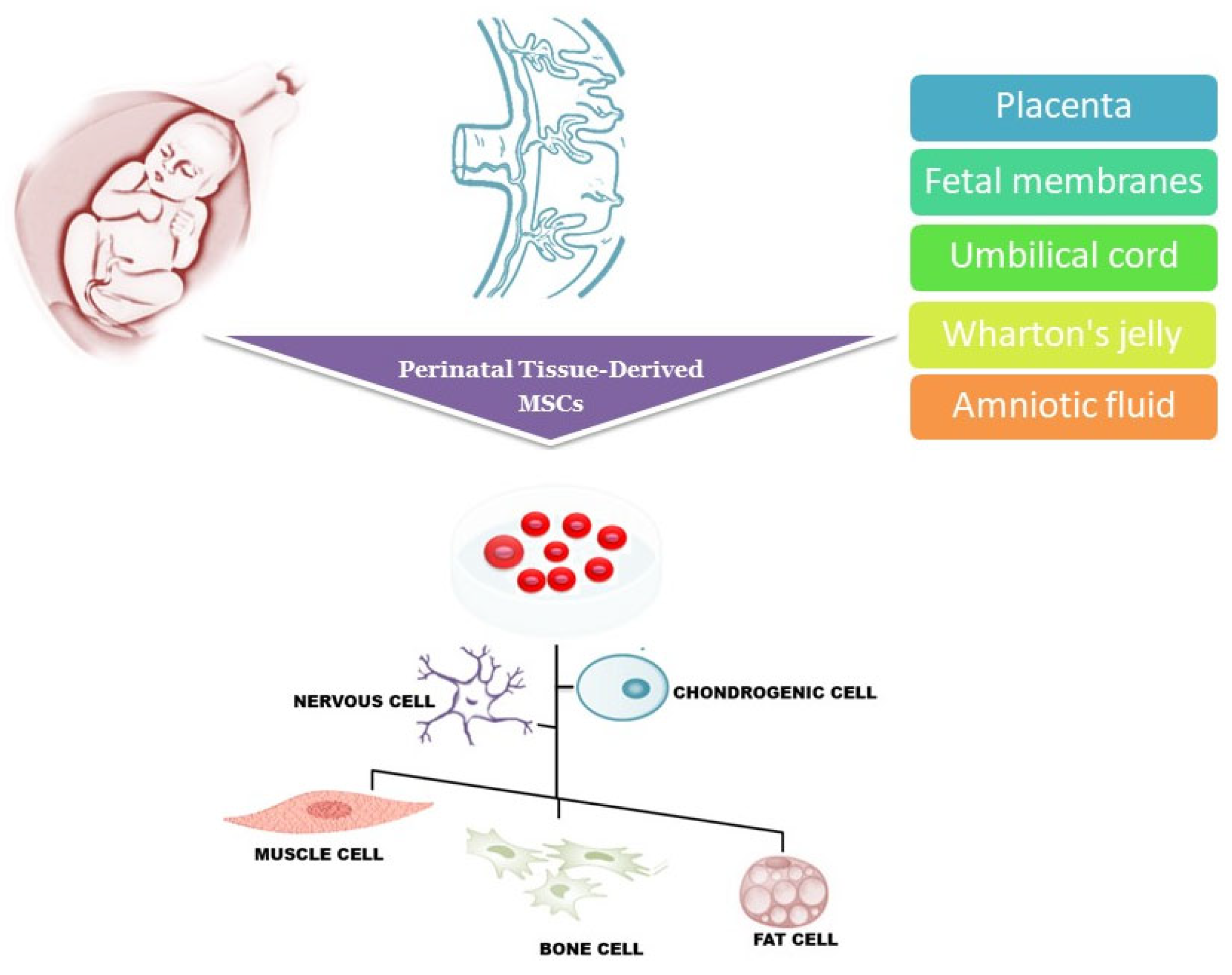
不同的细胞类型,如胚胎干细胞 (ESC)、成体干细胞和诱导多能干细胞 (iPS) 已被测试其在移植后替代受损细胞和恢复组织功能的能力。在过去的几年中,围产期组织源性间充质干细胞(MSC),包括胎盘源性、绒毛膜源性和脐带源性MSCs,由于其可获取性大、能够分化为多种细胞谱系而引起了极大的兴趣。图1),移植后不存在致瘤性,重要的是,缺乏伦理问题最初限制了胚胎干细胞的可用性。
从胎儿材料中分离干细胞不会引起伦理问题,因为这些组织在分娩后立即被视为医疗废物并且很容易获得。研究材料可以从整个怀孕期间、计划终止妊娠以及足月阴道分娩或剖腹产后的侵入性诊断和治疗程序中获得的组织中收集。
世界各地都在进行针对围产期干细胞的研究。美国和中国等几个国家已经制定了再生医学产品的法规。目前,每个欧盟成员国都有针对胚胎干细胞和围产期组织研究的具体规定。围产期干细胞临床试验必须得到当地生物伦理委员会的批准,并按照欧盟临床试验注册法进行。
截至2024年1月,全球已有2630项注册临床试验使用间充质干细胞疗法;然而,只有12种间充质干细胞疗法获得监管机构批准商业化。MSC批准的12种产品中有9种来自亚洲,而韩国是批准疗法最多的国家。其中,有NeuroNata-R,一种自体骨髓间充质干细胞疗法,具有神经保护作用,可以缓解ALS的进展。
围产期组织的干细胞成为治疗神经退行性疾病的新兴策略
本综述总结了关于围产期组织来源的间充质干细胞在治疗神经退行性疾病中的潜在用途及其临床局限性的生物学和转化研究的最新进展。
阿尔茨海默病的细胞疗法:临床试验的主要发现
| 试用ID | 阶段 | MSC型 | 学习规划 | 路线 | 数量 | 发现 |
|---|---|---|---|---|---|---|
| NCT01297218 | 完全的 | hUCB-MSCs | 第一阶段开放标签、单中心 | 单次脑室内输注 | 剂量A—每1个进入位点每5µL250,000个细胞,每个大脑300 万个细胞 剂量B—每1个进入位点每5µL 500,000个细胞,每个大脑600万个细胞 | 通过立体定向手术将 hUCB-MSC注射到海马和楔前叶 是安全且耐受性良好的,但无法对AD病理生理过程产生有益影响 |
| NCT01696591 | 未知 | hUCB-MSCs | NCT01297218的长期安全性和 有效性 随访 | 与NCT01297218相同 | ||
| NCT02054208 | 完全的 | hUCB-MSCs | 1/2a期,双盲,单中心 | Ommaya 水库脑室内 注射 | n=42每隔4 周 注射3次低剂量:1× 107 个细胞/2 mL高剂量:3×107 个细胞/2mL安慰剂组生理盐水 | 重复脑室内给药足够安全且 耐受性相对良好; 需要重复给药 以维持 治疗效果 |
| NCT03172117 | 未知 | hUCB-MSCs | NCT02054208 1期和2期长期随访 (随机四盲对照) | 与NCT01297218相同 | ||
| NCT04040348 | 积极的 | 同种异体 hUCB-MSC | 第一阶段,前瞻性、开放标签试验 | 鞘内 | n = 6一年内 每 13 周注射 4 剂 1 亿个 UCB-MSC | 不适用 |
| NCT04684602 | 招聘 | AM- 和 UC-MSC | 多中心、前瞻性、开放标签临床试验 | 通过特定情况的 给药途径注射 | n = 5000 | 不适用 |
| NCT01547689 | 未知 | 人脐带间充质干细胞 | 1/2 期、开放标签、单中心、自我对照临床试验 | 8 次静脉 输液 | n = 30 0.5 × 10 6 UC-MSCs/kg 每季度第一个月每两周一次 时间间隔: 两个半月 | 不适用 |
| NCT02672306 | 未知 | 人脐带间充质干细胞 | 多中心、随机、双盲、安慰剂对照试验 | 8 次静脉 输液 | n = 16 实验组:0.5 × 10 6 UCMSCs/kg,每两周一次 安慰剂组: 生理盐水,每两周一次 | 不适用 |
| NCT03899298 | 尚未 招募 | AM-和 UC-MSC | 阶段1 | 静脉 输注和鼻内手术 | n = 5000 | 不适用 |
尽管已经进行或正在进行多项临床试验来评估间充质干细胞治疗神经退行性疾病的疗效和安全性,但已发表的结果很少。
在NCT01297218和NCT01696591研究中,通过立体定向注射将同种异体hUCB-MSCs注射到AD患者的海马和楔前叶,在2年的随访期间没有出现剂量限制性毒性。常见的不良事件是手术过程中的伤口疼痛、头痛、头晕和术后谵妄,因此支持间充质干细胞移植的安全性和可行性。
Kim等人进行的I期临床试验。对9名轻至中度AD患者的研究也表明,人UCB-MSC脑室内移植是安全可行的。常见的不良事件是发烧、头痛、恶心和呕吐,并在36小时内缓解。总之,已经进行了多项临床试验来解决神经退行性疾病患者间充质干细胞移植的安全性。
总体而言,这些研究的结果支持自体和同种异体间充质干细胞移植的安全性和可行性。已发表的报告显示,移植并未形成肿瘤,治疗干预也未导致死亡。然而,尽管各种临床试验的疗效及其经过验证的安全性和可行性取得了令人鼓舞的结果。
干细胞治疗亨廷顿病
多项研究表明间充质干细胞在治疗亨廷顿病(HD)方面具有潜在功效。最近的一项荟萃分析证实了MSC对亨廷顿病动物模型的总体积极影响,反映在形态变化、运动协调性、肌肉力量、神经肌肉肌电图活动、皮质相关运动功能和纹状体相关运动功能上,而认知方面则没有。
MSC疗法改变了这一点。在不同的MSC来源中,骨髓MSC是研究最多的细胞,可有效改善运动协调性。然而,虽然能够减少HDR6/2小鼠模型的行为和组织学缺陷,但骨髓来源的MSC移植到小鼠纹状体后不会产生新的神经元。因此,其他来源的干细胞(主要是妊娠干细胞)越来越受到人们的关注。
埃布拉希米等人。(2018) 研究了UC-MSC在体外和体内对抗HD相关氧化应激的功效。他们发现这些细胞可以预防3-NP损伤的HD大鼠模型,这种模型会导致纹状体萎缩和行为障碍。他们还检测到UC-MSC中GDNF和VEGF的合成,其中GDNF在HD模型中显示出神经保护作用,而VEGF以剂量依赖性方式显示出神经存活特性。
| MSC型 | 细胞 数量 | 通道 数 | 鼠标 模型 | 移植途径 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| 间充质干细胞 | 20万 | P3 至 P8 或 P40 至 P50 | R6/2 和 WT 小鼠 | 纹状体内 | 移植小鼠的短暂行为保留; 高传代 UC-MSC 移植小鼠的神经病理学 (−) (↓); 营养因子和免疫调节细胞因子的释放(+),行为缺陷(−) | [ 142 ] |
| 间充质干细胞 | 250,000 | P4 | 3-硝基丙酸损伤小鼠 | 双侧纹状体 | 移植的MSC的存活和迁移(+); 纹状体体积和纹状体的平均树突长度 (+) | [ 129 ] |
| CM-hAMSC | 50万 | – | R6/2鼠标 | 腹膜内 | 紧握反射(↑); 运动协调和活动(↑); 纹状体神经病理学(↑); 对抗炎症的神经保护 | [ 114 ] |
总体而言,到目前为止,间充质干细胞治疗对亨廷顿病动物模型的积极作用已经显现,体现在形态变化、运动协调性、肌肉力量、神经肌肉肌电活动、皮质相关运动功能和纹状体相关运动功能上,即使MSC治疗并未显着影响认知能力。
然而,动物研究的数据并没有完全阐明移植细胞如何调节炎症细胞因子、趋化因子和神经营养因子的表达。这些问题也应该在临床试验之前得到解决。最后,需要强调的是,使用干细胞治疗亨廷顿病方案不仅应设计用于治疗亨廷顿病的临床发作,还应用于疾病预防。
干细胞治疗帕金森病的细胞疗法
帕金森病 (PD) 是由大脑黑质中多巴胺能神经元的丧失引起的。PD更常见于老年患者,影响70岁以上人口的约1-2%。目前的药物治疗包括施用多巴胺前体,可以改善症状但不能阻止疾病进展。
最近的研究进展表明细胞替代疗法是治疗帕金森病患者的一种强大的创新策略。近年来,再生医学领域取得了巨大进展,基于干细胞的疗法旨在替代丢失的多巴胺能神经元。
关于移植,多巴胺替代可以遵循两种不同的方案:
- 干细胞体外预分化为多巴胺能神经元和
- 植入后体内分化为多巴胺能神经元。
从文献报道的研究来看,干细胞治疗帕金森病的机制可分为两类修复:
- 直接修复途径,包括通过移植到神经元的细胞分化和/或整合来增加内源性神经发生。大脑神经回路受损;
- 通过营养因子进行间接修复,因为干细胞表达多种能够促进局部干细胞神经元分化的神经营养因子。
几项研究表明,妊娠干细胞移植到帕金森病动物模型后,可以改善功能,并具有神经保护和神经退行性作用。在PD大鼠模型中,已显示未分化的UC-MSCs阻止了48.4%的多巴胺神经元的退化和56.9%的多巴胺末端的丧失。其他研究人员描述了分化的hUC-MSC移植到多巴胺能神经元的功能益处,能够减轻运动症状。
总而言之,这些发现提供了证据表明必须解决有关细胞疗法的许多挑战和问题:
- 干细胞在宿主大脑中的长期存活;
- 将移植细胞主动整合到局部神经网络中;
- 副作用风险低;
- 患者大脑中多巴胺的生理释放。
| MSC型 | 细胞 数量 | 通道 数 | 鼠标模型 | 移植途径 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| 间充质干细胞 | 2×3.2×10 5 | P3 | PD大鼠模型 | 注射到纹状体的两个部位 | 旋转 不对称(↑); 多巴胺能分化 (+) | [ 152 ] |
| 人脐带间充质干细胞 | 1×10 3 | P9 | PD大鼠模型 | 单次立体定向注射 | 旋转次数(−); 阿扑吗啡引起的旋转 (↑) | [ 155 ] |
| 人脐带间充质干细胞 | 1×10 6 | – | 偏侧帕金森病啮齿动物模型 | 纹状体注射 | 旋转次数(−);hUC-MSCs在病变脑组织中 的迁移;分化为神经元样细胞;hUC-MSCs 归巢至病变脑组织的能力 | [ 156 ] |
| hUVMSC 衍生的多巴胺能样细胞 | 1×10 6 | P2-P5 | PD大鼠模型 | 立体定向注射入大鼠纹状体 | 移植细胞整合到纹状体中(+);脑组织中的 多巴胺水平(+);横向旋转(−);行为缺陷 (↑) | [ 159 ] |
| 人脐带间充质干细胞 | 1×10 6 | – | PD大鼠模型 | 立体定位注射至黑质 | 阿扑吗啡引起的旋转(↑); 改进旋转;人核特异性抗体(HNA)和酪氨酸羟化酶(TH) 的表达 | [ 160 ] |
| hUVMSC 衍生的多巴胺能样细胞 | 1×10 5 | P3 | PD大鼠模型 | 立体定向注射入大鼠纹状体 | 分化的 hUVMSC移植后存活率 (+); 大鼠脑中TH的表达; 阿扑吗啡引起的旋转 (↑) | [ 161 ] |
| 人AMSCs | – | – | PD大鼠模型 | 单侧 黑上注射 | hAMSCs移植细胞的存活率及hAMSCs对大鼠黑质多巴胺神经元 的保护作用 | [ 164 ] |
| 人AMSCs | 2×4×10 4 | – | PD大鼠模型 | 纹状体立体定向注射 | 阿扑吗啡引起的旋转不对称性恢复 (↑); hAMSCs 在纹状体中的存活 | [ 162 ] |
| hp-MSC 衍生的神经表型细胞 | 2×1.5×10 5 | – | PD大鼠模型 | 单侧注射至右侧内侧前脑束 | 运动缺陷的康复; 多巴胺能神经元损失 (−); 保护DA神经元损失; 移植细胞的存活和移植部位 分化为神经元;DLL-1、MASH1和NRTN(+) 的表达;调节受损大脑的免疫反应;神经保护和抑制神经炎症 | [ 166 ] |
| hUC-MSC 来源的多巴胺能样神经元 | 1×10 6 | P3 | PD大鼠模型 | 右侧纹状体立体定向注射 | 阿扑吗啡引起的旋转(↑); 纹状体中GFAP、Iba-1、TH、Nurr1、Pitx3、BDNF、TrkB、PI3K、p-Akt、Hsp60、TLR4 和 MyD88的表达 (+); 抑制黑质和纹状体的神经细胞凋亡; 神经保护和抗神经元炎症的可能机制 | [ 167 ] |
| WJ-MSCs | 2×1×10 6 | – | PD大鼠模型 | 注射至内侧前脑束 | 运动活动(↑); DA和TH浓度(+); | [ 168 ] |
| 试用ID | 阶段 | MSC型 | 学习规划 | 路线 | 数量 | 发现 |
|---|---|---|---|---|---|---|
| NCT03684122 | 主动, 不招聘 | 人脐带间充质干细胞 | 第一阶段 第二阶段 | 鞘内和静脉 注射 | – | 不适用 |
| NCT05691114 | 招聘 | 人干细胞 | 阶段1 | Ommaya 储库植入侧脑室 | 剂量A(5×107细胞/剂量) 剂量B(1.0×108细胞/剂量) 剂量C(1.5×108细胞/剂量)。 | 不适用 |
| NCT04414813 | 完全的 | 人干细胞 | 第一阶段早期 | hAESCs 立体定向移植 | 移植5000万个hAESC | 不适用 |
| NCT05435755 | 尚未 招募 | 人干细胞 | 第一阶段早期 | hAESCs精确移植至心室 | 总共将进行6例hAESC移植。 总共5000万个(2mL)hAESC将 通过Ommaya囊移植到参与者的心室中 (试验开始时设为第0天)。 随后,在第一次细胞移植后1个月±5天、2个月±5天、3个月±5天、6个月±5天、9个月±5天进行hAESC心室移植,体积为50每次百万个细胞(2 mL)。 | 不适用 |
| NCT04876326 | 未知 | 人脐带间充质干细胞 | 不适用 | 同种异体脐带间充质干细胞移植 | 脂肪组织来源的自体间充质干细胞植入 ,剂量为2×5000万个,间隔1个月 | 不适用 |
干细胞治疗肌萎缩侧索硬化症
目前再生医学的进展已提出以细胞为基础的疗法作为治疗ALS的新疗法。尽管处于临床转化的早期阶段,但许多临床前研究已经在动物模型中研究了干细胞的神经保护机制。最有希望用于此目的的是hUC-MSC,它在移植后很容易存活并且具有良好的迁移潜力。
2008年,Rizvanov等人。将转基因hUC-MSC移植到用作ALS动物模型的转基因G93A小鼠中。结果表明,移植细胞成功移植到神经组织中,并能分化为内皮细胞,形成新血管。在这份报告中,假设神经保护作用可能来自于新形成的血管输送各种神经营养因子。
| MSC型 | 细胞数量 | 通道数 | 鼠标 模型 | 移植途径 | 主要发现 | 参考号 |
|---|---|---|---|---|---|---|
| hUCBC | 100,000 | P4 | ALS小鼠模型 | 鞘内干细胞移植 | 对症状前运动表现的有益影响 (↑); 中枢神经系统内有大量移植细胞 | [172] |
| hUCBC | 1×10 6 | – | 转基因小鼠模型 | 椎管内注射 | 生存时间(+); 运动表现 (↑) 运动神经元损失和 脊髓星形胶质细胞增生 (−); | [174] |
| 表达 VEGF 的 hUCBC | 1×10 6 | – | ALS小鼠模型 | 眶后注射 | 移植到ALS小鼠神经组织中的HUCB整合; 存活时间超过3个月; 修饰后的HUCB细胞 在脊髓实质内迁移、增殖、分化为内皮细胞;神经保护作用 | [175] |
| SPIO标记的hUC-MSC | 4×10 5 | P5 | 成年大鼠模型 | 注射至背侧脊髓 | 受损大鼠脊髓内广泛的人类细胞存活 和植入(+); 促进运动恢复(↑); 移植后在宿主脊髓中的迁移 | [176] |
| SPIO 标记的 hUCBC | 100,000 | – | ALS小鼠模型 | 椎管内注射 | MRI检测ALS模型中SPIO标记的hUCBC ; 注射细胞无迁移 或脊髓错位 | [177] |
| hAFC | 100,000 | – | PD大鼠模型 | 摇摆器侧脑室移植 | 死亡率(−); 没有炎症反应和心室系统的 粗略改变 | [178] |
| 人AMSCs | 1×10 6 | P6-P8 | ALS小鼠模型 | 静脉给药 | 延缓疾病进展,延长生存时间(↑); 旋转杆上的运动性能 (↑) 防止体重减轻 (↑); 神经炎症(-); 脊髓腹角运动神经元损失(−); 小胶质细胞激活 (−) | [180] |
| 试用ID | 阶段 | MSC型 | 学习规划 | 路线 | 数量 | 发现 |
|---|---|---|---|---|---|---|
| NCT04651855 | 主动, 不招聘 | WJ-MSCs | 第一阶段 第二阶段 | 鞘内给药 | 每位入组患者3次 | 不适用 |
| NCT05003921 | 暂停(修改协议) | AlloRx UC-MSCs | 阶段1 | 鞘内注射 | 每隔两个月鞘内注射3次 5000万个细胞 | 不适用 |
| NCT01494480 | 状态未知 | 间充质干细胞 | 阶段2 | 干细胞移植 | 腰椎穿刺干细胞移植四次,两次治疗间隔3-5天 | 不适用 |
尽管多项研究表明间充质干细胞移植能改善疾病,但人们对间充质干细胞疗法产生有益影响的机制并不完全清楚。目前已观察到多种修复和支持机制,包括细胞替代、营养因子或基因递送以及免疫调节,有时这些机制会同时出现。间充质干细胞可发挥多种免疫调节作用,这可能是其对ALS有益的原因之一。
间充质干细胞可减少β细胞、T细胞和自然杀伤细胞的增殖,并损害树突状细胞的成熟。此外,间充质干细胞还可通过减少:
- β细胞产生抗体;
- 树突状细胞和T细胞的活化以及;
- 自然杀伤细胞的分泌来影响免疫细胞的功能。
在中枢神经系统中,间充质干细胞会迁移到炎症区域,减轻炎症。在渐冻症的实验模型中,间充质干细胞可减轻小胶质细胞的活化并减少星形胶质细胞的增生。
结论和未来展望
以细胞为基础的疗法被认为是治疗多种人类神经退行性疾病的一种很有前途的工具。值得注意的是,临床前研究已经证明,细胞移植在神经领域的功能性益处令人鼓舞,并且已经开展了多项工作,成功地将细胞疗法应用于神经退行性疾病。
目前,细胞疗法产生有益效果的分子机制与移植细胞产生神经营养因子、增强神经元可塑性、激活局部祖细胞和细胞替代相关(图3)。

图3:间充质干细胞移植在神经领域的功能益处的机制可能与其激活局部祖细胞和细胞替代、产生神经营养因子的能力有关,包括成纤维细胞生长因子 (FGF)、表皮生长因子 (EGF)、神经生长因子 (NGF)、脑源性神经营养因子 (BDNF)、胶质细胞源性神经营养因子 (GDNF),增强神经元可塑性和多种因子介导的免疫调节,包括吲哚胺 2、3-双加氧酶 (IDO)、前列腺素 E 2 (PGE 2 )、一氧化氮(NO)、转化生长因子(TGF)-β这些限制。
它们潜在的临床优势与(1)这些细胞的广泛可及性有关;(2) 是否有大量可用于移植的资源;(3)缺乏道德关注;(4)移植后无致瘤性;(5)分化成多个谱系的能力。
然而,关于分化神经元产生的功能状态仍然缺乏令人信服的证据。近年来,这些限制有力地促进了神经胶质细胞分化新方法的开发,最终可以治疗有需要的患者,包括通过局部电刺激和基于MSC的基因传递策略引导MSC分化为神经元的高度特异性系统。
因此,尽管需要解决一些问题和限制,但干细胞代表了临床治疗疑难杂症的一种有前途的治疗方法,有望延长和改善许多患者的生命。
参考资料:[1]:Bruno, A.; Milillo, C.; Anaclerio, F.; Buccolini, C.; Dell’Elice, A.; Angilletta, I.; Gatta, M.; Ballerini, P.; Antonucci, I. Perinatal Tissue-Derived Stem Cells: An Emerging Therapeutic Strategy for Challenging Neurodegenerative Diseases. Int. J. Mol. Sci. 2024, 25, 976. https://doi.org/10.3390/ijms25020976.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我.




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号