介绍
干细胞疗法是一种新技术,在过去几年中引起了极大的关注。2007年诺贝尔生理学或医学奖联合授予 Mario R. Capecchi、Martin J. Evans爵士和Oliver Smithies,以表彰他们发现利用胚胎干细胞在小鼠体内引入特定基因修饰的原理。干细胞已被用于广泛的治疗适应症,因此,新药和临床试验规则将“干细胞衍生产品”纳入新药部分。
在皮肤病学领域,干细胞疗法已在多种难治性疾病中进行了尝试,并取得了一些成功,拓宽了治疗手段。在本文中,我们旨在回顾干细胞治疗在皮肤病学中的现状。
材料和方法
使用PubMed、MEDLINE、Hindawi和Google Scholar检索相关英语文献。截至 2019 年的所有出版物均使用以下关键词进行识别:干细胞治疗、皮肤病学、造血、自体和同种异体。
所有关于在各种皮肤病中使用干细胞疗法的文章,包括病例报告、病例系列、随机对照试验和评论文章,均被考虑,并将研究结果(包括不良反应)制成表格。我们收录了与皮肤科干细胞和干细胞治疗的临床相关性相关的文章。我们排除了临床皮肤病学领域之外的文章,例如有关干细胞基础科学、兽医皮肤病学以及干细胞在其他医学领域中的应用的文章。
欧洲血液和骨髓移植组织 (EBMT)、英国血液和骨髓移植协会 (BSBMT)、美国血液和骨髓移植协会 (ASBMT) 和印度医学研究委员会 (ICMR) 编制的指南提供了全面的指导皮肤科干细胞治疗的适应症和现状概述。我们回顾了大约110篇关于这个主题的文章,这些文章构成了这篇评论文章的基础。
干细胞治疗的原理
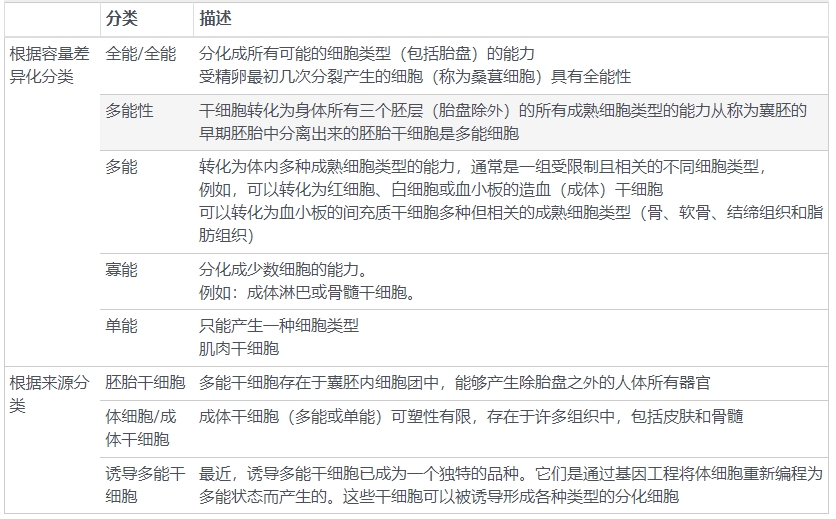
干细胞是存在于不同器官系统中的未分化细胞,具有自我更新、分化和可塑性三大特征[表1]。干细胞存在于一种称为干细胞生态位的特殊微环境中,它作为一个单位在受伤时维持体内平衡和修复组织。干细胞可以根据其来源和分化能力进行分类[表2]。
| 特征 | 定义 |
|---|---|
| 自我更新 | 能够经历多次不对称细胞分裂周期,产生分化细胞以及与亲本细胞相似的细胞,从而维持未分化细胞池 |
| 差异化 | 能够分化成干细胞所在组织的细胞 |
| 可塑性/反分化 | 成体干细胞跨越谱系障碍并分化为与原始组织不同的组织细胞的能力 |
表皮干细胞
在皮肤中,干细胞存在于毛囊间表皮(角质形成细胞)、毛囊隆起(角质形成细胞、黑素细胞和神经元)、皮脂腺、真皮乳头、真皮和皮下组织(间充质)中。黑素细胞干细胞可以通过紫外线、激光、磨皮和包括他克莫司在内的药物诱导,因此用于白癜风的色素重建。
正常情况下,表皮、毛囊和皮脂腺的干细胞彼此独立分化。在损伤期间,凭借可塑性,来自一个位置的任何干细胞都可以产生整个细胞谱系。
骨髓干细胞
骨髓含有造血干细胞和间充质干细胞。前者可以源自骨髓和脐带血,在免疫消融后用于治疗自身免疫性疾病,删除自身反应性细胞并用具有改善的自我耐受性的细胞重新填充。
间充质干细胞是源自几乎所有组织的多能成体干细胞,包括骨髓、脐带、外周血、皮肤、包皮、输卵管、肺、胎儿组织、胎盘、脂肪组织或羊水。
- 与造血干细胞相比,间充质干细胞由于MHC表达低而具有低免疫原性,并且还具有免疫调节作用,因此可用于治疗包括炎症性疾病在内的许多疾病。
- 与其他干细胞相比,它们还提供了更大的优势,包括相对容易的组织分离、对供体或伦理限制没有明显的风险、迁移和归巢到损伤部位的能力(例如向肿瘤性)、相对较长时间扩增的能力一段时间内,改变宿主免疫环境的能力和较高的转分化潜力。
异体造血干细胞治疗的步骤包括干细胞动员、干细胞采集、受体调理、干细胞输注和恢复[表3]。
| 步骤 | 评论 |
|---|---|
| 干细胞动员 | 骨髓中静止的造血干细胞通过各种粘附分子相互作用与成骨细胞、其他基质细胞和干细胞生态位中的细胞外基质相连。干细胞动员的目的是破坏这些生态位相互作用,从而导致干细胞从骨髓释放到外周血中。动员方案包括细胞毒剂(环磷酰胺)、造血生长因子(G-CSF、GM-CSF,均已获得 FDA 批准)、小分子趋化因子类似物(Plerixafor,一种 CXCR4 抑制剂,FDA 批准用于无法动员足够 CD34+ 的患者ASCT细胞)、重组单克隆抗体(那他珠单抗) |
| 干细胞的收集或收获 | 供体干细胞可以通过直接骨髓活检或通过外周干细胞动员和外周血采集来获得。随后,进行简单的血浆分离术或选择CD34+的干细胞操作,以防止自身反应性细胞的回输。在自体移植中,干细胞被储存在深冻条件/液氮中,细胞需要4周的时间来恢复并接受调理方案,而在同种异体移植中,收集和移植是在同一天完成的,消除存储需求 |
| 接受者的调理 | 在自体和同种异体移植中必须给予准备/调理方案以防止移植物排斥并减少肿瘤负荷。使用的药物包括放射疗法和化学疗法。 全清髓术在过去是常态,但随着人们认识到移植物抗肿瘤效应对同种异体 HCT 的成功具有重要作用,如今已开发出降低强度的非清髓性预处理方案以获得更好的接受度。调理方案的例子包括环磷酰胺、白消安、氟达拉滨、抗胸腺细胞球蛋白、阿糖胞苷、与I-131缀合的抗 CD45 抗体、高剂量 TBI (800–1320 cGy)。低剂量 TBI (200–400 cGy) |
| 干细胞输注 | 经过调理后,干细胞被解冻并重新注入骨髓或通过静脉注射。即使在外周循环中给予,干细胞也会回到骨髓并发生植入 |
| 恢复 | 在预处理方案之后,患者进入强烈的免疫抑制/骨髓抑制阶段,这与移植受者的死亡率和发病率增加有关。给予支持治疗,包括止吐、止泻、抗生素、抗病毒和抗真菌药物。当白细胞水平<1000、血红蛋白<7g、血小板<30,000时进行G-CSF、红细胞和血小板输注 |
干细胞在皮肤科的应用
| 良好的结果 | 有希望的结果 | 证据不足的结果 | 结果令人沮丧 |
|---|---|---|---|
| 系统性硬化症 SLE 天疱疮 | 牛皮癣 白癜风 | 伤口愈合 硬化性粘液水肿 脱发 HIV 黑色素瘤 美容医学 | 大疱性表皮松解症 默克尔细胞癌 |
干细胞治疗天疱疮
尽管天疱疮的一线治疗仍然是皮质类固醇和其他免疫抑制剂,但一些患者仍然难以治疗,因此必须探索其他疗法。一些研究表明,造血干细胞疗法已在天疱疮中取得成功。拟议的作用机制是移植的干细胞重新填充免疫系统,自身反应性免疫细胞的数量下降,这有助于恢复免疫平衡。
来自中国和国外的病例报告和小病例系列采用不同的动员和预处理方案,采用自体和异体造血干细胞疗法成功治疗顽固性天疱疮[表5]。感染是最常见的副作用,这些患者会出现败血症,有时甚至会导致死亡。
| 作者、年份 | 指示和包含 | 方法 | 结果 | 副作用 |
|---|---|---|---|---|
| Oyama等人,2004 年病例报告 | 难治性落叶型天疱疮。BSA-20% 对局部倍他米松、口服泼尼松、硫唑嘌呤、MMF、氨苯砜、环磷酰胺75毫克/天有抵抗力,持续9个月 | 自体HSCT动员 – 环磷酰胺和 G-CSF调理方案:环磷酰胺和rATG。每次rATG 给药前,甲基强的松龙1.0g/天 | 皮肤损伤在2个月内消退;维持至10个月泼尼松在4个月内逐渐减量 | 培养阴性中性粒细胞减少性发热、恶心、厌食 复发:鼻子和头皮上很少有红斑,对局部类固醇有反应 HSCT后19个月没有全身治疗 |
| Suslova等,2010 病例报告 | 寻常型天疱疮。 BSA-30% 对类固醇、甲氨蝶呤、氨苯砜、苯丁酸氮芥、硫唑嘌呤具有耐药性 | 同种异体HSCT 调理方案:阿仑单抗、300cGyTBI 辅助剂:口服西罗莫司 | 移植后第9个月严重程度下降 | 关节痛关节炎 复发:24个月无复发 |
| Vanikar等人,2012年例病例系列,11名患者 | 临床和活检证明寻常型天疱疮,对泼尼松龙和外用类固醇具有耐药性 | 细胞因子刺激的同种异体造血干细胞移植 | HSCT后24小时内开始恢复(皮损开始消退),6个月后新皮损停止出现。平均随访8.02年,所有患者均状况良好,没有复发/新病灶 | 在任何患者/捐赠者中均未观察到 GVHD/AE |
| Wang等人,2017年 病例系列,12名患者 | 寻常型天疱疮9例,红斑型天疱疮3例,落叶型天疱疮1例 大剂量类固醇或至少一种免疫抑制剂后病情持续<6个月;或患有类固醇相关疾病或类固醇严重禁忌症和并发症的患者 | 自体外周造血干细胞移植 | 80.33个月时总生存率为 91.6%,达到并维持完全缓解率为90.9% (10/11);6个月、1年和5年分别有81.8% (9/11) 和 75% (6/8) 的患者出现复发,其中两名患者在移植后5个月和6个月出现复发 | 感染(最常见的副作用)8 例(66.7%),败血症2例(16.7%),其中1例在移植后2个月死亡。其他不良事件:发热、头痛和转氨炎 |
现有文献表明造血干细胞疗法治疗天疱疮的疗效(推荐等级C,证据级别4);然而,需要进行更长时间随访的大规模多中心研究来证实结果。
干细胞治疗系统性硬化症
为了寻找明确的疾病缓解治疗方法,系统性硬化症是首批接受干细胞治疗的自身免疫性疾病之一。造血干细胞治疗旨在通过高剂量免疫抑制非特异性免疫消融异常的自身反应性Tand B细胞,随后通过输注患者先前收集的造血干细胞来重建更新且耐受的免疫系统。自体造血干细胞疗法优于同种异体疗法,因为前者的治疗相关死亡率较低且不存在移植物抗宿主病。
干细胞治疗在这种情况下已在三项随机对照试验 (RCT) 中得到了充分研究,即美国硬皮病干细胞与免疫抑制试验(ASSIST,第2期,19名患者)、自体干细胞移植国际硬皮病试验(ASTIS, 3期,156名患者)和硬皮病环磷酰胺或移植研究(SCOT,3期,75名患者),此外还有几个病例系列和试点研究。尽管方法略有不同,但所有研究都表明自体造血干细胞治疗是治疗系统性硬化症的一种有效、安全和可行的方式(证据级别-2a、2b.4)[表6]。
由于严重的主要器官受累(肺、心脏或肾脏)或严重的合并症是造血干细胞治疗的绝对禁忌症,因此这些患者被排除在所有三项试验之外。人们发现它比传统的免疫抑制疗法更有效,是目前唯一能改善长期生存、预防器官恶化、改善皮肤和肺功能以及改善患者整体生活质量的疾病修饰策略。欧洲和美国登记处提供的数据包括总体3年生存率约为80%,5年无进展生存率为55%。
| 作者、年份 | 指示和包含 | 方法 | 结果 | 副作用 (患者人数) |
|---|---|---|---|---|
| Oyama等人,2007年 例病例系列10名患者 | mRSS>13且内脏器官受累的弥漫性系统性硬化症 | 自体HSCT动员:环磷酰胺和G-CSF 调理方案:环磷酰胺加兔抗胸腺细胞球蛋白 结果测量:mRSS、PFT、HRCT、心脏和肾脏 | 6、12和24个月时mRSS显着改善 心、肺和肾功能 – 稳定 | 中性粒细胞减少性发热 – 5例 艰难梭菌结肠炎、培养阴性肺部浸润、液体超负荷、急性肾功能衰竭、植入综合征 – 各1 例患者化疗 相关恶心、呕吐、腹泻、乏力和轻度肝酶升高-大多数患者 |
| Nash等人,2007年 病例系列, 34名患者 | 早期(<4岁)弥漫性硬皮病 (mRSS>15) 和内脏器官受累 | 自体HSCT 动员:G-CSF 调理方案:环磷酰胺和马抗胸腺细胞球蛋白全身照射 移植后 – 泼尼松 | 一年生存率-79% mRSS和FVC显着改善 | CMV胃肠炎-1 菌血症-11 带状疱疹-6 致命肺部毒性-2 肾危象-6 室上性心律失常-2名患者心力衰竭-2 治疗相关死亡-8 (23%) 例 |
| Vonk等人,2008年回顾性研究26名患者 | 疾病快速进展(持续 2年),mRSS>20或疾病持续时间>2 年,mRSS进展 (>20%) 加上主要器官受累 | 自体HSCT 动员:环磷酰胺和 G-CSF 调理方案:环磷酰胺加抗胸腺细胞球蛋白 结果指标:mRSS、PFT、生存 | mRSS-19 (73%) 例患者1年后和15/16 (94%) 患者5年后mRSS显着下降FEV1或 DLCO 无显着变化5年无进展/无事件生存率 64.3%和57.1%7岁时 | 移植相关死亡率:1 例 (3.8%) 复发:2-4岁时6例 (28%) |
| Farge等人,2010年回顾性研究,175名患者 | 系统性硬化症 | 自体HSCT 清髓(全身照射)/非清髓(环磷酰胺/白消安/卡莫司汀、阿糖胞苷、美法仑和依托泊苷/抗胸腺细胞球蛋白) 结果指标:生存 | 总生存率:5年时为72.6% 无进展/无事件生存率:5年时为55% | 移植相关死亡率:12例(6.8%) |
| Burt等人,2011年2期ASSIST试验。19名患者单中心随机对照试验 | 弥漫性系统性硬化症 mRSS≥15,内脏器官受累,病程≤4 年,年龄<60岁 | 自体外周血HSCT(10名患者)与环磷酰胺冲击(9名患者) HSCT组:用环磷酰胺和G-CSF 动员调理方案:环磷酰胺加抗胸腺细胞球蛋白 对照组:环磷酰胺 1g/m2每月冲击,持续6个月。结果衡量:mRSS (>25%) 和FVC (>10%) 改善 平均随访期2.6年 | 干细胞组的所有患者在随访12个月或之前均有改善。没有患者出现疾病进展。随访期间FVC和mRSS持续改善。在对照组中,没有任何改善。 7名患者转而接受干细胞移植,之后4名患者接受了至少1年的随访,全部都出现了改善。两组在 12个月时和总体情况下均未出现死亡 | 心律失常(2名患者)、容量超负荷(2名患者)、CMV 感染重新激活(1名患者) |
| Henes等人,2012年 病例系列, 26名患者 | 环磷酰胺无效的系统性硬化症或快速进展的弥漫性疾病 | 自体干细胞移植 动员:环磷酰胺和 G-CSF 调理方案:环磷酰胺加抗胸腺细胞球蛋白 结果测量:mRSS、PFT | 21/23 (91%) 患者的mRSS评分有效率提高25% | 移植前死亡3例。 移植相关死亡率:4% 治疗相关死亡率:11% 复发:7名患者(随访4.4年) |
| Burt等人,2013年 回顾性研究,90名患者 | 弥漫性系统性硬化症 (mRSS >14) 和内脏器官受累(肺、心脏或胃肠道) | 自体HSCT 动员:环磷酰胺和G-CSF 调理方案:环磷酰胺和 rATG 结果测量:mRSS 和 PFT | mRSS和FVC有所改善。总肺活量和 DLCO未改善 | 治疗相关死亡率:5 例 (6%) |
| van Laar等人,2014年 ASTMIS 试验,156名患者多中心随机对照试验,第 3期 | 弥漫性系统性硬化症,mRSS≥15且内脏器官受累,病程≤4年,年龄18-65岁 | 自体HSCT(79名患者)与环磷酰胺冲击(77名患者)。动员:环磷酰胺和G-CSF 调理方案:环磷酰胺加抗胸腺细胞球蛋白 对照组:环磷酰胺 750mg/m2每月脉冲,持续12个月 结果测量:无事件生存直至死亡/持续性主要器官衰竭 中位随访5.8年 | HRCT组——MRSS、总肺活量、FVC 的显着改善 HSCT与治疗相关死亡率增加相关(8例,10%),而对照组在治疗后第一年没有这种情况。然而,HCST带来了显着的长期无事件生存获益 | 随访前2年出现 3 级或 4 级 AE:HSCT 组 51 例 (62.9%) 患者,对照组 30 例 (37%) |
| Henes等人,2014年 病例系列, 6 名患者 | 进行性系统性硬化症伴心脏表现(活检证实心肌纤维化) | 自体HSCT动员:环磷酰胺和G-CSF 调理方案:塞替派、环磷酰胺和 rATG 结果测量:mRSS、HRCT胸部和PFT | 6个月和12个月时mRSS评分显着改善。 4名患者>25%改善 中位肺密度和肺总量改善 FVC无显着改善 | 曲霉菌肺炎-2名患者 无移植相关死亡 复发:2名患者 |
| Del Papa等人,2017年 回顾性研究,18 名患者 | 病程<4年的快速进展的弥漫性系统性硬化症 接受常规疗法的对照组(36名患者) | 自体HSCT动员:环磷酰胺和非格司亭 调理方案:环磷酰胺和rATG 结果测量:mRSS、DLCO、使用 ESSG 评分系统 随访60个月的疾病活动度 | 与对照组相比,自体HSCT组在1年时 mRSS和DLCO显着降低,并在随访结束时保持不变。与对照组 (61%) 相比,自体HSCT组的死亡率 (5.8%) 显着降低 | 仅1例患者在随访期间因系统性硬化症相关表现死亡(34个月后发生致命性心律失常) |
| Sullivan等人,2018年 SCOT试验,75名患者 多中心随机、开放标签、3 期试验 | 弥漫性系统性硬化症,mRSS≥16且内脏器官受累,病程≤4年,年龄18-69岁 | 自体HSCT(36名患者)与环磷酰胺(39名患者) 动员:G-CSF 调理方案:分次全身照射、环磷酰胺和马抗胸腺细胞球蛋白 对照组:环磷酰胺500 mg/m2,随后每月750mg/m211个月的脉搏 结果测量:54个月时的全球排名综合评分 随访长达4.5年 | 移植组54个月无事件生存率为79%,环磷酰胺组为50%(P=0.02)。 72个月时,Kaplan-Meier 对无事件生存率(74%对 47%)和总生存率(86%对51%)的估计也有利于移植(P分别=0.03和0.02)。 移植组的治疗相关死亡率在54个月时为3%,在72个月时为 6%,而环磷酰胺组则没有 | 人年严重AE发生率:0.38(移植组)和0.52(环磷酰胺组)。每人年感染率(任何级别):0.75(移植组)和0.79(环磷酰胺组) 每人年3级或以上感染率:0.21(移植组)和0.13(环磷酰胺组) |
| Nakamura等人,2018年 14 名患者的 II 期试验长期随访 | 病程<3年的SSc患者,至少具有以下一项:mRSS)≥15、难治性指溃疡或间质性肺疾病 | 使用环磷酰胺调理后进行HSCT中 位随访期为137个月 | 10年总生存率为93%,无事件生存率为 40%。8名患者 (57%) 在HSCT后6个月内mRSS较基线下降超过50% | 6名患者 (43%) 发生了与HSCT相关的 AE。2名患者出现严重心肌病,其中1人死亡 |
| Nair等人,2018年 病例系列, 4名患者 | 弥漫性系统性硬化症,mRSS为15,1 个内脏器官受累 | 自体HSCT 动员:环磷酰胺和 G-CSF 调理方案:环磷酰胺加氟达拉滨加抗胸腺细胞球蛋白 结果测量:mRSS、PFT | 平均mRSS在1年后从基线24.5降至22.2,在随访4年后降至18.5。4年随访时,平均FVC从65%增加至78.5%,而 DLCO从55%增加至77.73% | 没有明显的手术相关副作用 |
干细胞治疗系统性红斑狼疮
造血干细胞疗法已在难治性系统性红斑狼疮(SLE)患者中尝试过。第一份自体造血干细胞治疗SLE成功的病例报告于1997年发表,随后进行了许多观察性研究和临床试验[表7]。
目前的文献表明,造血干细胞治疗是短期难治性疾病的一种选择。欧洲血液和骨髓移植学会和英国血液和骨髓移植学会将严重耐药性疾病的自体造血干细胞治疗归类为“临床意见”,即在评估风险和获益后即可进行。美国血液和骨髓移植协会的指南将成人治疗归类为“发育性”治疗。
| Farge等人,2010 年多中心观察性研究,85名患者 | 所有连续接受干细胞移植的自身免疫性疾病患者 | 自体HSCT 动员:环磷酰胺和G-CSF或单独G-CSF 调理方案:全身照射或单药化疗或基于环磷酰胺、白消安和 BEAM±抗胸腺细胞球蛋白的组合 | 5 年时,总生存率 – 76% 无进展生存率 – 44% | 100天时,移植相关死亡率–11% |
| Alchi等人,2012 年回顾性研究,28名患者 | 2001年至2008年向 EBMT登记处报告的患者 | 自体造血干细胞移植 | 5年总生存率:81±8% 无病生存率:29±9% 非复发死亡率:15±7% 复发率:56±11% | 严重/危及生命的AE:31例(15例-感染,3例-严重免疫事件,1例-移植后EBV相关淋巴增殖性疾病,继发性自身免疫性疾病-2例, 心血管事件-2例) 死亡人数:5例(3例- 感染,1例-自身免疫性疾病)溶血性贫血 |
| Leng等人,2017 年前瞻性队列研究,27名患者 | 严重SLE(WHO III或 IV级狼疮性肾炎、进行性肺功能障碍或肺纤维化、狼疮性脑病复发、横贯性脊髓炎或灾难性抗磷脂综合征) | 大剂量免疫抑制治疗及自体外周血干细胞移植 | 6个月时21例(87.5%)缓解,2例部分缓解,1例死亡,14例完成10年随访。 10年总生存率和10年缓解生存率均为86%,16例(66.7%)患者仍处于缓解状态,4例失访,2例死亡,1例患者保持活动状态 | 感染(CMV、细菌、两者)- 12名患者 (44.4%)、恶心、呕吐、脱发、转氨炎 |
| Burt等人,2018 年前瞻性队列研究,30名患者 | 难治性系统性红斑狼疮,依赖类固醇,有器官损伤,死亡风险高 | 使用两种不同的非清髓性预处理方案进行自体HSCT 4名患者(第1 组):环磷酰胺 (200mg/kg) 和阿仑单抗 (60mg) 26名患者(第2组):环磷酰胺 (200 mg/kg)、rATG(胸腺球蛋白)( 5.5毫克/公斤)和利妥昔单抗 1000毫克 | 第1组:无一例进入缓解 第2组:疾病缓解(定义为除羟氯喹和/或≤10mg/天泼尼松外不使用免疫抑制药物)在6个月时为92%,在1年时为92%,在2年时为81%,HSCT后3年为71%,4年和5年为 62% 结论:自体HSCT的结果取决于预处理方案 | 无治疗相关死亡 感染 – 鼻窦炎 (5)、UTI (6)、VZV (3)、URTI (7)、艰难梭菌 (3)、流感 (3)、蜂窝织炎 (2) 其他、髋AVN、肾上腺功能不全、急性ITP |
| Cao等人,2018年 前瞻性队列研究, 22名患者 | 既往治疗失败的SLE(泼尼松龙0.5mg/kg 至少2个月,或甲泼尼龙脉冲治疗6个月,或环磷酰胺500mg/m2/月×3个月) | 自体HSCT 环磷酰胺+ATG调理方案 | 3年和5年 无进展生存率分别为77.27%和67.9%, 总生存率为95.2%。移植后100 dANA、抗dsDNA、抗Sm抗体和24小时尿蛋白滴度显着下降,而补体3 (C3) 和C4则恢复正常(P<0.05) | 感染(病毒、细菌、PCP和结核) 移植后3年内CMV再激活的发生率为59.09% |
间充质干细胞在包括系统性红斑狼疮在内的多种自身免疫性疾病中的治疗潜力已得到探索。已发现它在 SLE中安全有效,可降低疾病活动性、改善肾功能、减少自身抗体产生、外周Treg上调以及重建Th1和Th2相关细胞因子之间的平衡。它们的免疫调节和再生特性使其成为一种有前途的SLE新型疗法。
干细胞治疗银屑病
尽管近年来在阐明银屑病发病机制方面取得了相当大的进展,但确切的机制尚不完全清楚。目前,人们注意到某些类型的干细胞功能障碍可能是银屑病炎症反应失调的主要原因。这一想法源于注意到银屑病患者接受造血干细胞治疗并随后获得长期缓解。
相比之下,也有银屑病捐献者骨髓移植后获得性银屑病的病例报道。这表明造血干细胞在疾病发病机制中发挥着重要作用。间充质干细胞也已在少数研究中得到成功尝试。临床益处可能归因于间充质干细胞植入或其旁分泌或免疫调节作用。然而,具有成本效益、安全的替代方案的存在阻碍了干细胞移植作为治疗牛皮癣的可行选择。
干细胞治疗大疱性表皮松解症
尽管迄今为止还没有针对这种遗传性疾病的具体治疗方法,但正在研究各种治疗方式,旨在纠正潜在的遗传缺陷并恢复皮肤屏障。干细胞疗法就是这样一种基于细胞的疗法。可以通过皮内或静脉注射来自供体的间充质干细胞,可以从同种异体供体进行骨髓移植,或者可以对患者的干细胞进行基因改造和移植。虽然造血干细胞疗法未能实现其最初的承诺,但同种异体间充质干细胞疗法可能有助于缓解某些症状。
在Conget等人的一项研究中,两名患有严重全身性隐性营养不良性大疱性表皮松解症 (EB) 的患者接受皮内注射来自骨髓的同种异体间充质干细胞治疗,结果显示治疗部位周围的溃疡在12周时完全愈合。干预后一周,沿基底膜区检测到VII型胶原蛋白,且治疗部位的真皮-表皮连接处是连续的。然而,两位患者的临床效果仅持续了4个月。
尽管最初的临床改善很有希望,但由于缺乏持久蛋白质(胶原蛋白和层粘连蛋白)的产生,这种改善并没有随着时间的推移而持续。目前使用干细胞疗法治疗EB的证据有限,因为接受这种疗法的患者总数较低,因此需要进一步研究来评估疗效和潜在风险与获益的相关性。
干细胞治疗伤口愈合
表皮干细胞在适当的刺激下具有再生表皮并分化成各种细胞类型和组织的潜力。这一特性可用于促进和加速慢性不愈合伤口的愈合。间充质干细胞已被证明可以通过减少炎症、促进血管生成和减少疤痕来促进伤口愈合。法兰加等人。使用专门的纤维蛋白喷雾系统,成功地将人类间充质干细胞应用于无法愈合的急性伤口。
干细胞治疗白癜风
药物治疗是白癜风的一线治疗方法,当治疗失败时,可以考虑手术治疗。
白癜风新型手术技术的开发已取得重大进展。手术方式大致可分为组织移植和细胞移植。自体非培养外根鞘毛囊细胞悬液(NCORSHFS)是最近描述的一种细胞移植技术。它基于的原理是,毛囊黑素细胞具有显着的再生能力,这使得它们成为白癜风细胞疗法中令人垂涎的黑素细胞来源,而不是表皮。
莫汉蒂等人。在他们的开创性研究中报告了NCORSHFS的使用,并报告平均色素沉着率为65.7%。9/14(64.2%) 的患者实现了超过75%的再色素沉着。疾病稳定性持续时间少于12个月的患者的平均色素沉着率明显较低。
此外,多谱系分化耐应激(MUSE)细胞是另一种类型的干细胞,可用于治疗白癜风。三维皮肤培养模型的离体研究已经确定了诱导MUSE细胞分化为黑素细胞的因素,黑素细胞整合到表皮中并导致黑素生成。体内效果尚未确定。
干细胞治疗硬化性粘液水肿
硬化粘液水肿是一种罕见的慢性纤维粘液性疾病,可能因呼吸系统并发症而导致高死亡率。莱西等人。研究了五名接受干细胞救援大剂量化疗的患者,发现它可以为大多数患者提供持久的缓解,尽管它不能治愈。
伊拉等人通过化疗和自体干细胞移植成功治疗了硬化粘液水肿。六个月后患者完全康复,移植后三年仍处于缓解状态。
干细胞治疗脱发
尽管干细胞疗法在头发修复中的应用相对较新,并且干细胞分离技术也各不相同,但迄今为止在雄激素性脱发(AGA)和斑秃(AA)方面的结果都是有希望的。
安德里等人。通过吸脂收集自体脂肪来源的基质血管细胞,并将其注射到20名AA患者的头皮中。在三个月和六个月的随访中,他们发现所有患者的毛发生长具有统计学意义。脂肪干细胞条件培养基 (ADS-CM) 富含血管内皮生长因子、肝细胞生长因子、血小板源性生长因子和胰岛素样生长因子ILGF等生长因子,也可用于治疗脱发。
李等人介绍了一种新型干细胞方法,称为“干细胞教育者疗法”,其中将患者的单核细胞从全血中分离出来,并使其与人类脐带血来源的多能干细胞相互作用,然后这些“受过教育”的细胞返回到患者的循环中。在9名严重AA患者中,除一名外,其他患者的头发再生情况都有不同程度的改善。两名患者(一名患有全秃,一名患有斑片状脱发)在12周时头发完全再生,两年后没有复发。富含血小板的血浆和干细胞技术的结合也显示出了有希望的结果。
干细胞治疗人类免疫缺陷病毒
迄今为止,还没有针对艾滋病毒的治愈方法。HIV与CD4受体结合,之后需要CXCR4或CCR5作为辅助受体才能进入靶细胞。
2009年,Hütter等人。报道了一例被称为“柏林患者”的HIV-1感染急性髓系白血病病例,该病例接受了两次同种异体HSCT,来自具有纯合CCR5delta32等位基因的捐赠者。移植后,停止高效抗逆转录病毒治疗(HAART),患者在 20 个月的随访中仍处于缓解状态。
十年后,另一名霍奇金淋巴瘤HIV患者接受了具有纯合CCR5 delta32等位基因供体的同种异体移植,移植后 16个月后可以停止抗逆转录病毒治疗,停止ART18个月后患者病情得到缓解。
干细胞治疗默克尔细胞癌
它是一种罕见的皮肤肿瘤,没有标准的转移性疾病治疗方案。近年来,人们对默克尔细胞癌生物学的了解不断加深,特别是对于作为病原体的默克尔细胞多瘤病毒,这表明健康的人类皮肤含有能够进行肿瘤转化的常驻或暂时性多瘤病毒。
据报道,多瘤病毒阳性和多瘤病毒阴性默克尔细胞癌在形态、基因表达、信号通路、基因组和表观遗传改变、微小RNA谱、免疫监视失调、异常蛋白表达和翻译后修饰方面存在显着差异,这些差异影响了默克尔细胞癌的总体预后。
最近的研究表明,多瘤病毒阳性和阴性默克尔细胞癌源自两种不同的细胞来源:来自表皮干细胞的病毒阴性癌和来自真皮干细胞的病毒阳性默克尔细胞癌。对默克尔细胞癌干细胞可能参与的进一步研究可以为靶向治疗的临床前开发提供平台重要基础。有报道称,联合化疗联合自体外周血干细胞移植可导致病情缓解,但只持续了六个月。
干细胞治疗黑色素瘤
黑色素瘤是一种侵袭性的、相对对放射和化学疗法具有抵抗力的肿瘤,即使采用包括癌基因定向疗法和免疫疗法在内的新疗法也难以治疗。
最近,有人提出癌症是一种肿瘤持续存在依赖于一小群肿瘤起始细胞(肿瘤干细胞)的疾病。这一概念虽然最初是针对人类骨髓性白血病建立的,但最近已被考虑用于黑色素瘤(黑色素瘤干细胞)。这些肿瘤干细胞能够自我更新,因此具有无限增殖的能力,对许多治疗方法具有抵抗力并诱导肿瘤复发。因此,未来的治疗可以针对黑色素瘤干细胞生物标志物、微环境和黑色素瘤干细胞作为治疗选择。
黑色素瘤干细胞已被证明表达CD20表面标记、ABCB5(一种 ABC 转运蛋白)以及其他标记,包括 CD133、CD271和乙醛脱氢酶。由于黑色素瘤干细胞表达CD20,因此已在临床试验中尝试使用利妥昔单抗治疗黑色素瘤,使化疗难治性黑色素瘤消退。
干细胞治疗美容医学
脂肪干细胞已被证明可以激活成纤维细胞并分泌各种生长因子,从而在皮肤中产生抗氧化、淡化色素和伤口愈合的效果。它们已被有效用于治疗动物模型中的皱纹。成纤维细胞在伤口愈合和恢复丢失的真皮成分方面发挥着至关重要的作用;培养的自体成纤维细胞在美容医学领域显示出广阔的前景。
干细胞治疗的难点
- 伦理考虑:包括同意、保密、传染病筛查和程序风险等问题。
- 法律问题:印度有许多未经授权的中心提供未经证实的干细胞疗法。局限性在于,目前最好的办法只是指南而非法律,因此建议与实施之间存在差距。遏制这种做法的一种方法是制定严格的规则,并将所有干细胞及其产品视为需要进行药物试验的药物,然后才能批准用于特定疾病管理。
- 同种异体移植中存在移植排斥的可能性。
- 多能干细胞的致瘤性——当干细胞长时间培养时,可能会发生不良突变,并且可能异常分化形成肿瘤。
- 必须评估干细胞或其产品的保存对其活力和效力的影响。
- 细胞加工和制造的质量控制必须符合 1940 年《药品和化妆品法》附表 M 中规定的规则,这是所有临床试验的必要条件。
- 未来关于理想患者选择、干预时机、适当调理方案、干预后护理和成本效益的研究将有助于优化干细胞治疗的结果。
参考资料:Khandpur S, Gupta S, Gunaabalaji DR. Stem cell therapy in dermatology. Indian J Dermatol Venereol Leprol 2021;87:753-67.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请及时跟本公众号联系,我们将在第一时间处理。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号