干细胞代表了医学和制药领域的一种新的治疗选择。干细胞已越来越多地用于治疗许多疾病。事实上,它们催生了一个称为再生医学的新医学时代。
近年来,再生医学尤其是干细胞药物的使用已成为疾病治疗的新革命。干细胞药物是指基于活体干细胞的产品,用作特定疾病的药物。与自体干细胞移植不同,干细胞药物是“现成”产品,无需任何进一步操作即可使用。本综述旨在总结一些已批准的干细胞药物,并讨论再生医学和个性化医学的革命。此外,该综述还将讨论干细胞药物如何引领干细胞治疗的新方向,为满足患者需求提供新平台。

介绍
干细胞被认为是人类生长发育的起源。干细胞分离、增殖和修饰的能力和相关性催生了干细胞在疾病治疗中的应用领域。如今,干细胞在疾病治疗(干细胞疗法)中的应用具有巨大的潜在益处。迄今为止,已有超过100种不同的疾病通过干细胞移植得到治疗。Donald等人于20世纪50年代首次应用造血干细胞 (HSC)。表明干细胞可以用作治疗疾病的药物。
随着HSC治疗的疾病越来越多,HSC的临床应用迅速增加。从20世纪70年代到2000年代,所有造血干细胞移植 (HSCT) 均适用于治疗血液系统恶性肿瘤。近年来,HSCT也被用于实体瘤治疗。
人类白细胞抗原(HLA)匹配是成功HSCT的重要组成部分。因此,在HSCT的最初几年,几乎所有病例都是采用自体HSC移植。干细胞是从骨髓、脐带血或外周血中收集的。然而,自体造血干细胞移植也有一些局限性,特别是在造血干细胞的质量和数量方面。更重要的是,自体造血干细胞的基因组中存在一些突变,这限制了它们在治疗遗传性疾病中的应用。为了克服这些限制,同种异体HSCT被认为是一个更好的平台;可以控制质量和数量更高的选定HSC样品的使用。
鉴于异体造血干细胞移植的需求,中国、美国、日本、韩国、英国和德国等多个国家都建立了干细胞库。随着HSC的进一步表征(包括HLA分型),从2000年代开始,干细胞能够在美国作为移植用药品进行商业化。Ducord和HemaCord是2010年左右在美国推出的两种HSC药物。然而,由于人类HLA匹配率很低(约1/100,000),HSC药物的业务发展缓慢。
从2012年至今,干细胞药物以间充质干细胞(MSC)为基础的产品取得了进展。与HSC类似,在MSC的首次临床应用中,MSC以自体移植的方式施用。事实上,移植前要考虑HLA匹配和免疫排斥。一些间充质干细胞的同种异体移植已使用免疫抑制药物来预防或减少移植细胞在宿主体内的免疫排斥反应。然而,越来越多的研究证实间充质干细胞表现出强大的免疫调节能力,可以调节宿主的免疫系统;此外,与 HSC和其他细胞相比,它们表现出较低的免疫原性。
MSC已被移植到没有免疫抑制且没有HLA匹配的患者中是安全的,基于这些结果,基于MSC的产品现已开发为针对具有明确适应症的患者的药物。第一个基于间充质干细胞的干细胞药物于2012年获得加拿大食品和药物管理局的正式批准。该药物用于治疗与HSCT相关的移植物抗宿主病(GVHD)。
本文旨在总结和讨论干细胞药物在医学和药学领域的发展和成长。干细胞药物现已成为再生医学的一个新的、潜在的重要成员。图1
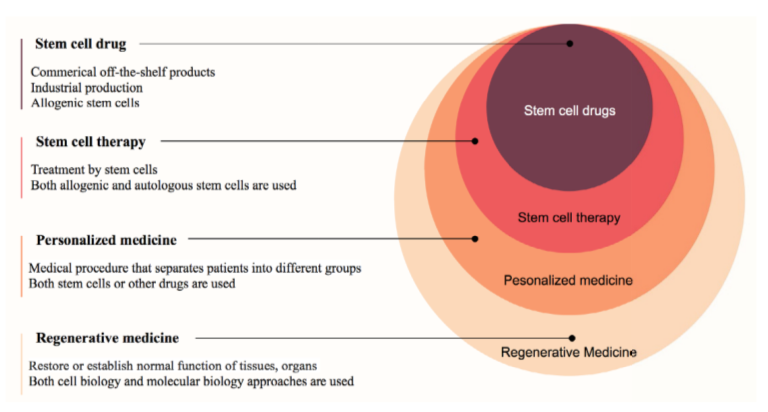
什么是干细胞药物?
药物是指除食物以外的任何物质,当吸入、注射、吸食、食用、通过皮肤贴片吸收或溶解于舌下时会引起人体生理变化。在药理学中,药物(或药品)是一种用于治疗、治愈、预防或诊断疾病或促进健康的物质。
根据这一定义,药物必须满足一些标准,如具有治疗任何疾病的适应症,并且是现成的产品。因此,根据定义,干细胞药物是以干细胞为基础,用于治疗、治愈、预防或诊断疾病或促进健康的现成产品。
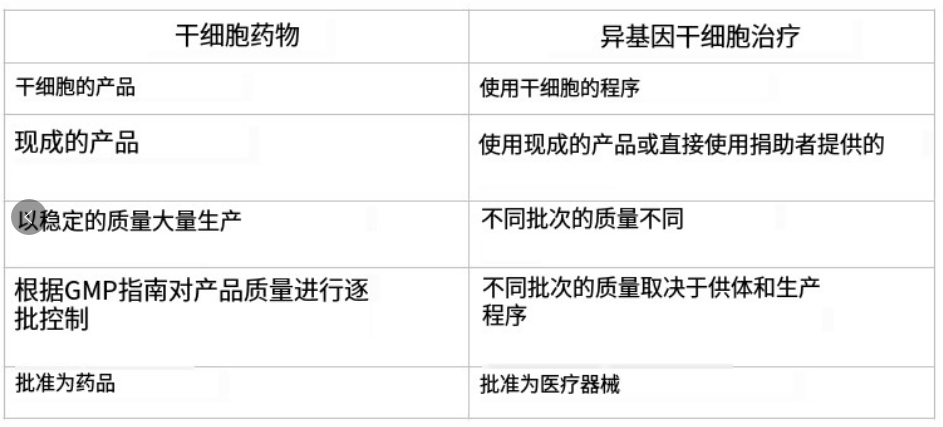
作为现成的产品,干细胞药物用于干细胞移植中的异体移植。异基因干细胞移植与干细胞药物之间存在主要区别。它们之间最大的区别在于,干细胞药物是一种产品,而异体干细胞移植是使用干细胞药物的一种程序。此外,前者被批准为药物,后者被批准为医疗器械。主要区别详见表1。
干细胞药物:从个性化到通用化
个性化医疗是一种将患者分为不同组的医疗程序,根据患者的预测反应或疾病风险,为患者量身定制医疗决策、实践、干预措施和/或产品。
干细胞为个性化医疗提供了一种新方法。事实上,使用干细胞的“个性化医疗”的定义在过去十年已经成为一个流行术语。迄今为止,至少有两种在个性化医疗中使用干细胞的方法,如图2所示。
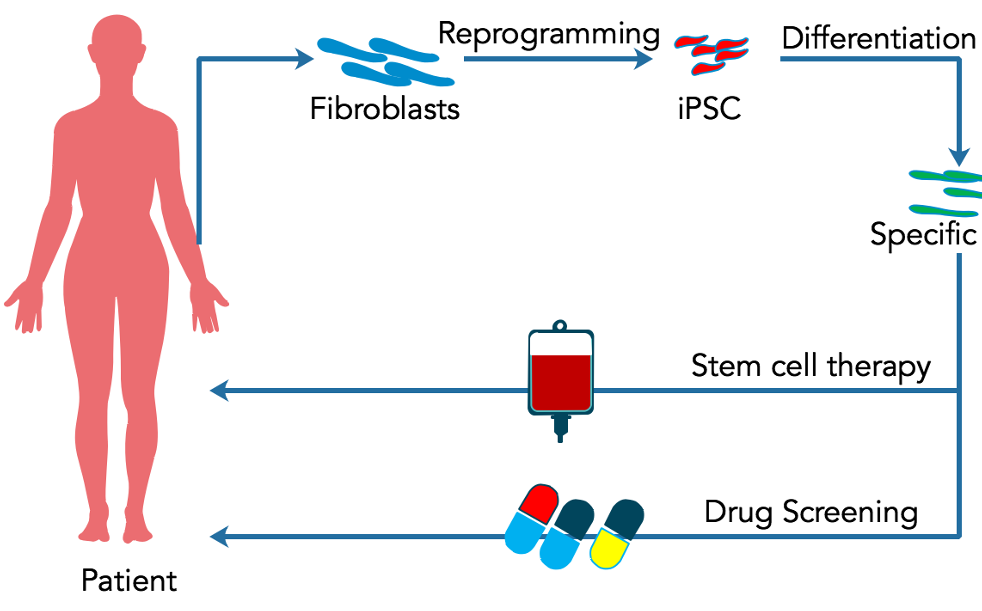
在这篇综述中,我们主要讨论干细胞在干细胞治疗移植中的应用。在干细胞移植中,患者的自体干细胞被用来治疗其疾病。然而,干细胞的质量和数量因衰老而减少,是这种方法的一大局限。然而,在山中(Yamanaka)成功地从皮肤成纤维细胞中制造出诱导多能干细胞(Takahashi and Yamanaka,2006年)之后,科学家们希望个性化医学能利用自体重编程干细胞用于个性化医学的诱导多能干细胞$最初从皮肤中分离出的成纤维细胞被重编程为诱导多能干细胞(iPSCs)。
iPSC进一步分化为特定的移植到患者体内之前的细胞类型。迄今为止,这种方法面临着许多限制,并且被证明是相当困难的。即使与该方法相关的所有技术困难和限制可以在不久的将来得到解决,该程序的高价格仍然是一个挑战。事实上,临床应用的成纤维细胞分离、培养和重编程过程非常复杂、耗时且昂贵。
普及医学干细胞药物已成为干细胞治疗的新选择。干细胞药物可以克服自体干细胞的所有主要局限性。特别是质量、数量和价格都可以控制。虽然个性化医疗需要更多的开发时间,并且在某些方面是一种面向“未来”的医学形式,但普遍化医疗更加“真实”,因为可以使用“现成的”同种异体干细胞药物对于许多患者来说。
干细胞药物:药物机制和特性
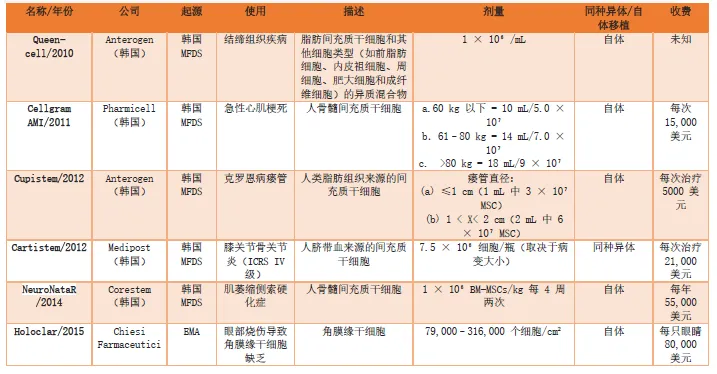
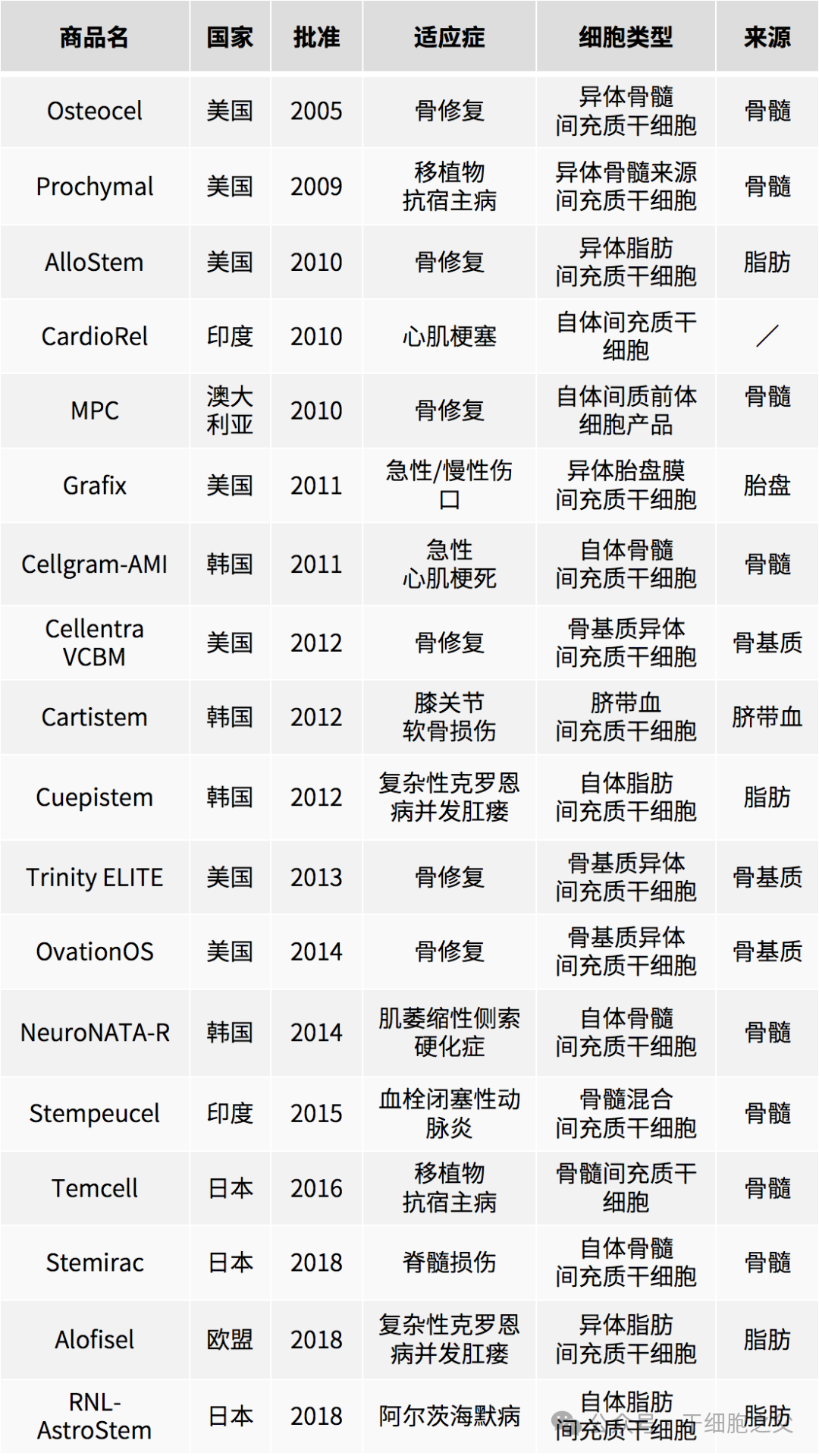
干细胞药物主要由造血干细胞和间充质干细胞产生(表3)。然而,另一种干细胞(角膜缘干细胞)也可以用来生产一些用于角膜再生的产品。这些干细胞药物的作用机制各不相同。虽然基于HSC的药物可以使治疗患者的造血系统再生(通过归巢和分化为功能细胞),但基于 MSC的药物通常针对免疫系统,并通过旁分泌或内分泌因子促进受伤部位的愈合。
基于造血干细胞的药物
造血干细胞是可以通过造血过程产生血细胞的干细胞,包括白细胞、红细胞和血小板。在成人中,造血干细胞位于骨髓中并维持体内的血液系统。
自1961年首次发现HSC以来,HSC的定义一直在演变。造血组织含有具有长期和短期再生能力的细胞以及定型多能、寡能和单能祖细胞。如今,HSC存在于骨髓、外周血和脐带血中,并且大多是从其中分离出来的。
1950年代,Fred Hutchinson癌症研究中心(美国华盛顿)的E. Donnall Thomas进行了第一例成功的骨髓造血干细胞移植;他的工作后来获得了诺贝尔生理学或医学奖。托马斯注入骨髓细胞以重新填充骨髓并产生新的血细胞。
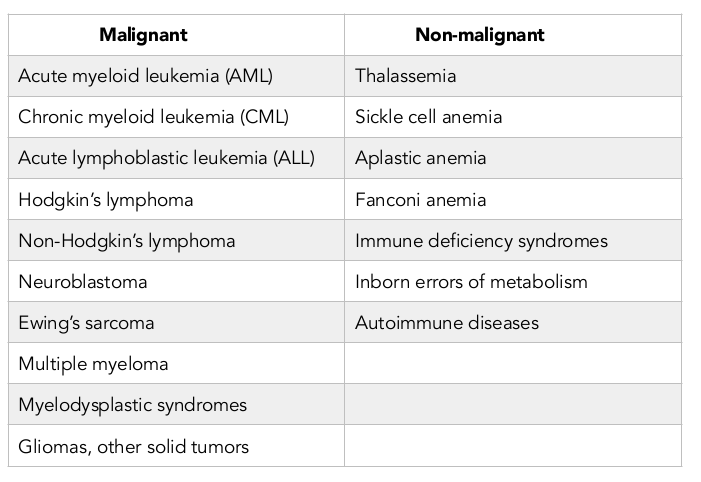
此外,第一位成功进行人类骨髓移植治疗癌症以外疾病的医生是1968年明尼苏达大学的Robert A.Good。迄今为止,HSCT已在多种恶性和非恶性疾病中进行了评估。表2
造血干细胞在骨髓中的归巢和分化形成新的造血系统决定了造血干细胞在恶性和非恶性疾病中的作用。然而,HSC对宿主免疫系统具有很强的免疫原性。因此,HSCT前的HLA配型至关重要。然而,由于人类中HLA匹配度极低,HLA匹配的要求限制了基于HSC的干细胞药物的开发和进步。
而且,很难在体外诱导干细胞增殖以增加细胞数量。尽管脐带血似乎是无限HSC来源的良好候选者,但它也面临限制其应用的挑战,包括脐带血细胞采集、富集和表征(例如HLA分型)的高成本和时间。
基于间充质干细胞的药物
间充质干细胞(MSC)是人体内最受欢迎的干细胞。它们几乎存在于所有组织中,但最常见的来源是骨髓、脂肪组织、脐带组织、脐带血和胎盘。尽管来自不同组织的MSC具有共同的特性,但正如Dominici等人所建议的,它们也表现出不同的特性。与其他种类的干细胞不同,间充质干细胞具有多功能性;它们不仅分化成多种细胞谱系,而且还产生大量细胞因子和生长因子来执行免疫调节并促进损伤愈合和组织再生。
间充质干细胞由于其多谱系分化潜力而有利于干细胞治疗的临床应用。干细胞可以在体外或体内分化成功能细胞,从而替代老化或受损的细胞。
人们已经观察并证实了骨髓、脂肪组织、脐带和华通氏胶中的间充质干细胞具有免疫调节作用。与免疫抑制(即所有免疫细胞的功能都受到抑制)不同,免疫调节是一个动态过程,其中只有部分细胞受到影响,即只有部分细胞受到刺激。通过免疫调节,MSC可以有效抑制急性和慢性炎症。一些基于MSC的干细胞药物已在某些国家获准使用,并已显示出发挥免疫调节作用的能力;其中一个例子是第一个干细胞药物(Prochymal),它被评估用于治疗GVHD,并获得加拿大食品和药物管理局的批准。
干细胞药物的第二个主要机制与干细胞产生的生长因子有关。间充质干细胞可以产生一系列生长因子和细胞因子,对其他细胞产生生物效应。MSC可以产生刺激宿主干细胞、抑制细胞凋亡和刺激血管生成的因子。一些细胞因子发挥旁分泌作用,而另一些则可能具有内分泌作用。
目前,间充质干细胞临床试验已经超过1300项,用于治疗各种疾病。最常见的是,间充质干细胞作为一种细胞治疗制剂,正在进行如火如荼的临床试验。通常,间充质干细胞移植后会很快消失,可能是通过旁分泌发挥功能。
目前来看,间充质干细胞已成为全球开展临床研究项目数最多的细胞。
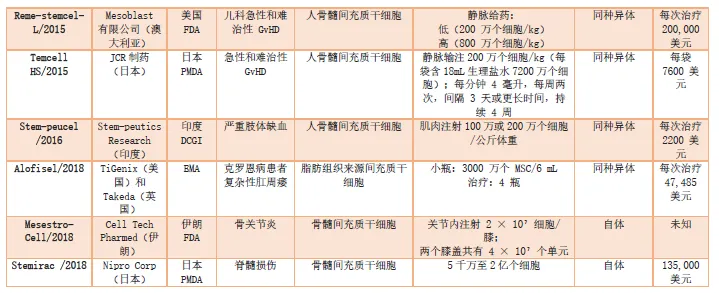
据不完全统计,全球曾经获准上市的间充质干细胞产品有18款,符合药品定义的有10款。
其中,3款与澳大利亚Mesoblast公司有关,4款来自韩国,3款来自日本、印度。
干细胞药物的未来
近年来,干细胞治疗研究已从使用整个干细胞发展到使用源自干细胞的成分。这些成分包括干细胞提取物、微泡和外泌体,所有这些都表现出各种生物活性。例如,来自间充质干细胞的外泌体具有与整个间充质干细胞相似的功能,包括修复组织损伤、抑制炎症反应和调节免疫系统。
- 胡等人证明,来自人类脂肪干细胞的外泌体可以通过优化成纤维细胞的特性来加速皮肤伤口愈合。与MSC类似,来自MSC的细胞外囊泡 (EV) 可以调节免疫系统。
来自干细胞的外泌体还可以影响其他系统和器官,例如心血管系统、肾脏、肝脏、神经系统和肌肉骨骼系统。
在心血管系统中,外泌体已被建议作为心脏保护剂;它们已被证明具有促血管生成作用并参与减少细胞凋亡和心脏纤维化。
- 阿尔斯兰等人表明,由于生物能重建(增加ATP产生)、氧化应激减少和促生存信号激活(增强PI3K/Akt信号),单次静脉注射外泌体可有效增强心肌梗死后的心脏功能和几何结构。
- 张等人)表明MSC衍生的外泌体在体外促进心脏干细胞增殖。
在肾脏方面,研究表明基于MSC的外泌体可以有效治疗急性肾损伤。
此外,MSC衍生的外泌体还可用于治疗纤维化肝病。
在肌肉骨骼系统的一些疾病中,外泌体可以触发间充质干细胞分化为成骨细胞并通过增强肌生成和血管生成来刺激骨骼肌再生。
在神经系统中,MSC衍生的外泌体已在神经系统和神经退行性疾病的治疗中进行了评估;它们已被证明可以增强血管生成和神经生成、减少炎症并改善空间学习和感觉运动功能。
总而言之,上述发现预示着干细胞治疗新时代的到来,即干细胞药物。在这里,微泡或外泌体中干细胞的成分(mRNA、蛋白质和肽)可以对整个干细胞有效。当然,干细胞药物的优点包括降低免疫原性以及易于加工、储存和运输。无干细胞药物可能在再生医学中发挥潜在的重要和新兴作用。
结论
干细胞药物是由干细胞产生的药物的新成员。2012年至今,已有十余种干细胞药物在各国获批进入临床。这些产品可能含有活的造血干细胞或间充质干细胞。
干细胞药物凭借其免疫原性降低、易于加工等优点,已成为全球干细胞治疗领域有前景的新平台。干细胞药物作为医药新产品,预计在不久的将来将为制药和医疗行业做出巨大贡献。在临床应用方面,除了含有活干细胞和完整干细胞的干细胞药物外,含有干细胞成分(如提取物、外泌体和囊泡)的新型干细胞药物也在开发中,预计很快就会上市。
参考文献:
1. JA Ankrum,JF Ong和JM Karp。间充质干细胞:免疫逃避,不是免疫特权。自然生物技术。2014; 32:252-260。
2. FR Appelbaum。50岁时的造血细胞移植。《新英格兰医学杂志》。2007; 357:1472-1475。
3. BA Armson,DS Allan,RF Casper。脐带血:咨询,收集和银行业务。妇产科杂志 2015; 37:832-846。
4. 间充质干细胞来源的外来体可增加ATP水平,降低氧化应激并激活PI3K / Akt途径,从而增强心肌活力并防止心肌缺血/再灌注损伤后的不良重塑。干细胞研究。2013; 10:301-312。
5. L. Bai,DP Lennon,V.Eaton,K.Maier,AI Caplan,SD Miller,RH Miller。在多发性硬化症动物模型中,人骨髓来源的间充质干细胞可诱导Th2极化的免疫反应并促进内源性修复。胶质 2009; 57:1192-1203。
6. 是什么使脐带组织源间充质基质细胞与骨髓源间质基质细胞相比具有更高的免疫调节性?干细胞诠释2015.2015; :583984。
7. S.Bian,L.Zhang,L.Duan,X.Wang,Y.Min,H.Y。在大鼠心肌梗死模型中,源自人骨髓间充质干细胞的细胞外囊泡可促进血管生成。J Mol Med(Berl)。2014; 92:387-397。
8. J. Burrello,S. Monticone,C. Gai,Y. Gomez,S. Kholia,G. Camussi。干细胞衍生的细胞外囊泡和免疫调节。前细胞开发生物学。2016; 4:83。
9. AI Caplan,JE Dennis。间充质干细胞作为营养介质。细胞生物化学杂志。2006年;98:1076-1084。
10. L. Chen,EE Tredget,PY Wu,Y。Wu。间充质干细胞的旁分泌因子募集巨噬细胞和内皮细胞谱系并增强伤口愈合。一。2008年;3:e1886。
11. AJ Cutler,V.Limbani,J.Girdlestone,CV Navarrete。脐带间充质基质细胞调节单核细胞功能以抑制T细胞增殖。J Immunol。2010; 185:6617-6623。
12. 定义多能间充质基质细胞的最低标准。国际细胞疗法学会立场声明。细胞疗法。2006年;8:315-317。
13. Y. Feng,W. Huang,M. Wani,X. Yu,M. Ashraf。缺血预处理通过miR-22靶向Mecp2,通过分泌外来体来增强干细胞的保护作用。PLoS一。2014; 9:e88685。
14. 急性心肌梗死后静脉内成年人间充质干细胞(间充质)的随机,双盲,安慰剂对照,剂量递增研究。美国心脏病学会杂志。2009; 54:2277-2286。
15. 霍金(AM Hocking),NS Gibran。间充质干细胞:皮肤伤口修复过程中旁分泌信号传导和分化。实验细胞研究。2010; 316:2213-2219。
16. MJ Hoogduijn,F。Popp,R。Verbeek,M。Masoodi,A。Nicolaou,C。Baan,M.-H。达尔克 间充质干细胞的免疫调节特性及其在免疫治疗中的应用。国际免疫药理学。2010; 10:1496-1500。
17. 通过优化成纤维细胞的特性,源自人脂肪间质干细胞的外泌体可加速皮肤伤口的愈合。科学代表.2016; 6:32993。
18. J. Hyun,S. Wang,J. Kim,GJ Kim,Y.Jung。MicroRNA125b介导的刺猬信号通过绒毛膜板间充质干细胞影响肝脏再生。科学代表.2015; 5:14135。
19. 人尿来源的干细胞分泌的外来体可以预防大鼠I型糖尿病引起的肾脏并发症。干细胞治疗。2016; 7:24。
20. 阿布拉姆斯基。间充质干细胞移植治疗多发性硬化症和肌萎缩性侧索硬化症的安全性和免疫学作用。神经病学档案。2010; 67:1187-1194。
21. DK Kim,H。Nishida,SY An,AK Shetty,TJ Bartosh,DJ Prockop。色谱分离的间充质基质细胞分离的CD63 + CD81 +胞外小泡可挽救TBI后的认知障碍。Proc Natl Acad Sci美国A.2016; 113:170-175。
22. RM Kotloff,VN Ahya,SW克劳福德。实体器官的肺部并发症和造血干细胞移植。美国呼吸与重症医学杂志。2004; 170:22-48。
23. MSC分泌的外泌体减少了心肌缺血/再灌注损伤。干细胞研究。2010; 4:214-222。
24. MM Lalu,L。McIntyre,C。Pugliese,D。Fergusson,BW Winston,JC Marshall,J。Granton,DJ Stewart。间充质基质细胞(SafeCell)的细胞治疗的安全性:临床试验的系统评价和荟萃分析。一。2012; 7:e47559。
25. 高分辨率的供体-受体HLA匹配有助于无关的供体骨髓移植的成功。血液。2007; 110:4576-4583。
26. 来自人脐带间充质干细胞的外泌体减轻了肝纤维化。干细胞开发 2013; 22:845-854。
27. MK Majumdar,MA Thiede,SE Haynesworth,SP Bruder,SL Gerson。人骨髓间充质干细胞(MSC)在分化为基质和成骨细胞系时表达造血细胞因子并支持长期造血作用。血液疗法和干细胞研究杂志。2000; 9:841-848。
28. 卡瓦略。脂肪组织来源的间质基质细胞可通过调节抗寄生虫免疫力保护感染克鲁斯锥虫的小鼠免受心脏损害。PLoS Negl TropDis。2015; 9:e0003945。
29. Y. Nakamura,S. Miyaki,H. Ishitobi,S. Matsuyama,T. Nakasa,N. Kamei,T. Akimoto,Y. Higashi,M. Ochi。间充质干细胞来源的外来体加速骨骼肌再生。FEBS Lett。2015; 589:1257-1265。
30. R. Narayanan,CC Huang,S。Ravindran。劫持细胞邮件:外来体介导的间充质干细胞分化。干细胞诠释。2016; 2016:3808674。
31. M.P De Miguel,S.Fuentes-Julian,A.Blazquez-Martinez,C.Y Pascual,M.A Aller,J.Arias,F.Arnalich-Montiel。间充质干细胞的免疫抑制特性:研究进展和应用。目前的分子医学。2012; 12:574-591。
32. EW Petersdorf,TA Gooley,C.Anasetti,PJ Martin,AG Smith,EM Mickelson,AE Woolfrey,JA Hansen。通过全面匹配供体和受体中的HLA I类和II类等位基因,优化无关骨髓移植后的结果。血液。1998年;92:3515-3520。
33. SJ Prasanna,D。Gopalakrishnan,SR Shankar,AB Vasandan。促炎性细胞因子IFNgamma和TNFalpha对人类骨髓和沃顿氏果冻间充质干细胞的免疫特性产生不同的影响。PLoS一。2010; 5:e9016。
34. I.拉斯穆森。间充质干细胞的免疫调节。实验细胞研究。2006年;312:2169-2179。
35. G.Ren,L。Zhang,X。Zhao,G。Xu,Y。Zhang,AI Roberts,RC RC,Y。Shi。间充质干细胞介导的免疫抑制通过趋化因子和一氧化氮的协同作用而发生。细胞干细胞。2008年;2:
36. 大剂量化疗与造血干细胞抢救对高危乳腺癌的治疗作用。新英格兰医学杂志。2003; 349:7-16。
37. I类HLA等位基因匹配对来自无关供体的造血干细胞移植后临床结局的影响。新英格兰医学杂志。1998年;339:1177-1185。
38. 高桥K.山中S. 通过确定的因子诱导小鼠胚胎和成年成纤维细胞培养物的多能干细胞。细胞。2006年;126:663-676。
39. 在高危乳腺癌中进行或不进行大剂量化疗和自体干细胞移植的常规辅助化疗。新英格兰医学杂志。2003; 349:17-26。
40. JE Till,CE认证 直接测量正常小鼠骨髓细胞的放射敏感性。Radiat水库。1961年;14:213-222。
41. 王友宝 韩永平 宋振汉 间充质干细胞在临床上的安全性。国际干细胞。2012; 2012年。
42. ML Weiss,C.Anderson,S.Medicetty,KB Seshareddy,RJ Weiss,I.VanderWerff,D.Troyer,KR McIntosh。人脐带沃顿氏胶来源的细胞的免疫特性。干细胞。2008年;26:
43. 张Y.M.肖普M.Meng.M. Katakowski,H.Xin A.Mahmood,熊Y. 多能性间充质基质细胞外泌体对脑外伤后大鼠功能恢复和神经血管可塑性的影响。神经外科杂志。2015; 122:
44. Z. Zhang,J。Yang,W。Yan,Y。Li,Z。Shen,T。Asahara。用间充质干细胞衍生的外来体预处理心脏干细胞可增强心肌修复。J Am Heart Assoc。2016; 5。
45. 人脐带间充质干细胞释放的外来体在体内外均能抵抗顺铂诱导的肾脏氧化应激和细胞凋亡。干细胞治疗。2013; 4:34。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号