根据之前的体内研究和人体试验,鞘内细胞输送是一种安全且相关的治疗手段,可改善神经系统疾病患者的生活质量。
2024年5月20日国际医学期刊杂志《Stem Cell Research& Therapy》发表了一篇“通过鞘内注射进行间充质干细胞治疗神经系统疾病的安全性:随机对照试验的系统评价和荟萃分析”的文献综述。
该综述旨在描述鞘内输送间充质干细胞 (MSC) 的安全性。综述表明鞘内注射MSCs与肌肉骨骼和结缔组织疾病相关的不良事件略有增加有关,尽管没有严重的不良事件。我们得出结论,鞘内注射间充质干细胞对神经系统疾病患者是安全的。
什么是神经系统疾病
神经系统疾病是影响中枢和周围神经系统的多种疾病,会导致认知和感觉运动功能下降,是全球显著的疾病负担,导致生活质量下降。神经系统疾病导致的死亡人数为900万,占全球死亡人数的16.5%,是仅次于心血管疾病的第二大死亡因素 。大多数神经系统疾病的特点是广泛的神经元死亡和大脑再生潜力微弱。此外,与其他疾病相比,可用的治疗选择受到限制。
间充质干细胞的特性与移植途径
根据目前研究表明,间充质干细胞具有独特的特性,例如自我更新能力和分化成各种细胞的能力。先前的临床试验已经评估了它们作为神经系统疾病治疗方法的安全性和有效性,包括阿尔茨海默病、痴呆、帕金森病、脊髓损伤、脊髓性肌萎缩和多发性硬化症。MSCs表现出对损伤部位的趋向性,并分泌多种生长和神经营养因子,引发免疫调节和神经保护作用,促进神经元存活和再生。因此,MSC疗法可被视为改善神经功能障碍的重要方法。
MSC疗法可通过各种途径到达蛛网膜下腔,包括动脉内、静脉内、病变内和鞘内。据观察,动脉内或静脉内途径向病变区域输送细胞的效果不佳,因为细胞可能无法穿过血脑屏障 (BBB) 或可能滞留在其他器官中。尽管MSC具有很高的穿过BBB的潜力,但将其输送到鞘内可产生最显著的治疗效果,从而提高受损中枢神经系统区域附近的细胞生物利用度。此外,鞘内细胞治疗后似乎没有出现重大严重不良事件 (SAE),这表明许多细胞可以无风险地注入 。

此外,对照临床试验表明,鞘内注射MSCs组和假手术/安慰剂对照组的SAE发生率相当。尽管如此,在间充质干细胞治疗神经系统疾病中,静脉途径仍然是最常用的,其次是鞘内注射。这种偏好可能归因于与腰椎穿刺和MSCs注射相关的潜在风险引起的伦理考虑。
在本系统综述和荟萃分析中,我们的主要目标是根据符合纳入标准的RCT证据,评估鞘内注射MSCs对成年神经系统疾病患者的安全性。
方法
我们搜索了以下电子数据库:Ovid MEDLINE、Embase、Scopus、Cochrane Library、KCI-Korean Journal Database 和Web of Science Databases,从数据库建立到2023年4月13日,对数据库进行了搜索。纳入了比较成人群体中MSCs鞘内注射与对照组的随机对照试验 (RCT)。
汇总不良事件 (AE) 并使用DerSimonian-Laird随机效应模型进行荟萃分析,对零计数细胞的研究添加校正因子0.5。使用风险比 (RR) 和95%置信区间 (95%CI) 描述汇总的AE。然后,对研究级汇总数据进行随机效应元回归模型,以探索AE的发生与被认为会修改总体效应估计的协变量之间的关系。
结果
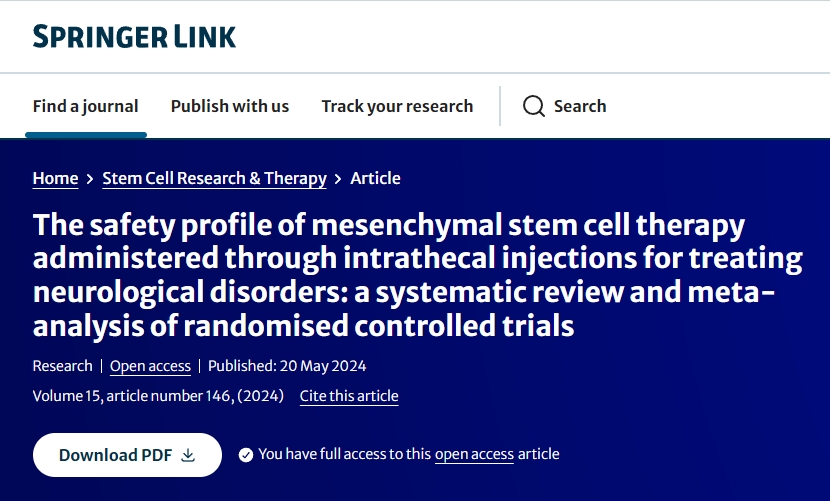
研究选择:共从文献检索中提取了581篇文章。在使用自动化工具删除重复研究后,对303篇文章进行了标题和摘要筛选。在这些文章中,选择了13篇进行全文审查。最后,九项RCT被纳入研究质量评估和数据分析。文献检索和研究纳入过程如图1所示。
研究特征:共纳入9项RCT(n=540例患者),样本量从10至189例患者不等;随访期从1天至14个月不等,发表日期从2013年到2021年。纳入的RCT在六个不同的国家进行:白俄罗斯(2项RCT)、美国(2项RCT)、西班牙(1项RCT)、中国(2项RCT)、以色列(1项RCT)和韩国(1项RCT)。七项研究招募了来自单中心的患者,两项研究为多中心研究。
表1列出了纳入的9项RCT的研究特征和参与者的详细信息,例如年龄、性别、干预组和对照组、地点、随访、临床状况和剂量。在纳入的研究中,三项 (33.33%) RCT使用骨髓间充质干细胞 (BM-MSC) ,两项 (22.22%) 使用脐带间充质干细胞UC-MSC,四项 (44.44%) 使用诱导分泌高水平神经营养因子的骨髓间充质干细胞 (BMMSCs-NTF)。

| Fedor Hlebokazov 等人,2021 年 | 白俄罗斯 | 患有 DRE 的患者(n =67) | 单中心 | 12 | AED辅以单次静脉注射自体 BM-MSC,随后单次静脉注射BMMSC-NTF 细胞 | 传统 AED | 33·5±10·34 | 33·4±10·7 | 20/14 | 18/15 | ITT | 单次静脉注射自体BM-MSC(1.0 – 1.5×106细胞/千克),随后一周内单次静脉注射 BMMSC-NTF(0.1×106细胞/千克) |
| Cudkowicz 优异 E.,2022 年 | 美国 | ALS患者(n=189) | 多中心 | 3 | BMMSC-NTF(NurOwn®,由波士顿丹娜法伯癌症研究所生产) | 安慰剂 | 48·1±9·71 | 49·1±8·38 | 27/68 | 35/59 | ITT | 125×106NurOwn® (BMMSC-NTF 细胞) |
| 阿尔布·塞尔吉乌,2021 年 | 西班牙 | 因创伤原因导致完全性脊髓损伤的患者 (n=10) | 单中心 | 12 | 先输注UC-MSC,然后输注安慰剂 | 先注射安慰剂,然后输注 UC-MSCs | 31±6·04 | 34·4±10·36 | 2/3 | 1/4 | ITT | 10×106个脐带间充质干细胞 |
| 宋华.,2020 | 中国 | 急性脊髓损伤患者(n = 36) | 单中心 | 12 | 对照组治疗+蛛网膜下腔自体BM-MSCs注射 | 减压+内固定+常规药物治疗 | 41·2±2·3 | 41·7±2·1 | 6/12 | 8/10 | ITT | 自体10×106BM-MSC |
| Petrou Panayiota.,2020 年 | 以色列 | 患有活动性或恶化性 MS 的患者 (n = 64) | 单中心 | 14 | 自体BM-MSC 和静脉注射生理盐水 | 假治疗(生理盐水) | 第1组:49.05±7.2。第2组:47.42±10.4 | 第3组:45.89 ± 10.9 | 第 1 组:6/10。第 2 组:10/6 | 第 3 组:4/12 | ITT | 自体1×106BM-MSC/kg |
| Berry James D.,2019年 | 美国 | ALS患者(n=48) | 多中心 | 6 | 自体骨髓间充质干细胞 | 安慰剂 | 50·3±11·90 | 53·5±9·11 | 11/25 | 2/10 | ITT | 自体125×106BMMSC-NTF细胞和在24个不同部位进行24次肌肉注射48×106BMMSC-NTF |
| 噢,基旭,2018 | 大韩民国 | 无家族病史的ALS 患者 (n=64) | 单中心 | 6 | 自体BM-MSCs 每隔26天应用一次+利鲁唑 | 利鲁唑治疗(100 毫克/天) | 53·7±7·7 | 52·5 ± 9·4 | 14/18 | 16/11 | ITT | 使用IT自体BM-MSC进行两次重复治疗(1×106BM-MSC/kg,间隔26 天) |
| 费多尔·赫列博卡佐夫,2017 | 白俄罗斯 | 患有DRE 的患者(n=22) | 单中心 | 12 | AED辅以单次静脉注射自体 BM-MSC,随后5-7天单次静脉注射 BMMSC-NTF | 标准抗癫痫药物治疗 | 31.5(20–44)中值(范围) | 32.5(18–56)中位数(范围) | 4/6 | 5/7 | ITT | 自体1×106BM-MSC/kg,随后5-7 天单次IT注射 BMMSC-NTF 0.1×106MSC-NTF/kg |
| 王森,2013 | 中国 | 患有TBI后遗症的患者(n=40) | 单中心 | 6 | UC-MSCs组 | 控制组 | 27·50±9·43 | 28·64±10·13 | 3/17 | 5/15 | ITT | 10×106个脐带间充质干细胞 |
关于剂量,2项(22.22%)RCT施用的细胞剂量≤106,7项(77.78%)施用的细胞剂量在107至108个之间。7项(77.78%)RCT使用自体MSC, 2项(22.22%)使用不匹配的同种异体MSC。6项(66.67%)RCT使用新鲜细胞,3项(33.33%)在给药前使用了冷冻保存的MSCs。纳入的RCT均未使用异种产品,九项(100%)RCT在无异种培养基中培养MSCs。在干预组的283名患者中,103名接受了单剂量治疗,180名接受了多剂量治疗。
所有纳入的RCT均使用鞘内 (IT) 注射作为治疗给药途径。最常见的标准治疗是抗癫痫药物 (AED),例如利鲁唑。一些重要的MSCs特性,例如来源(自体或不匹配的同种异体)、MSC制备(新鲜或冷冻保存)、无异种培养基、给药频率(单剂量或多剂量)和剂量,与每一项纳入的研究相关。
不良事件 (AE) 和严重不良事件 (SAE)
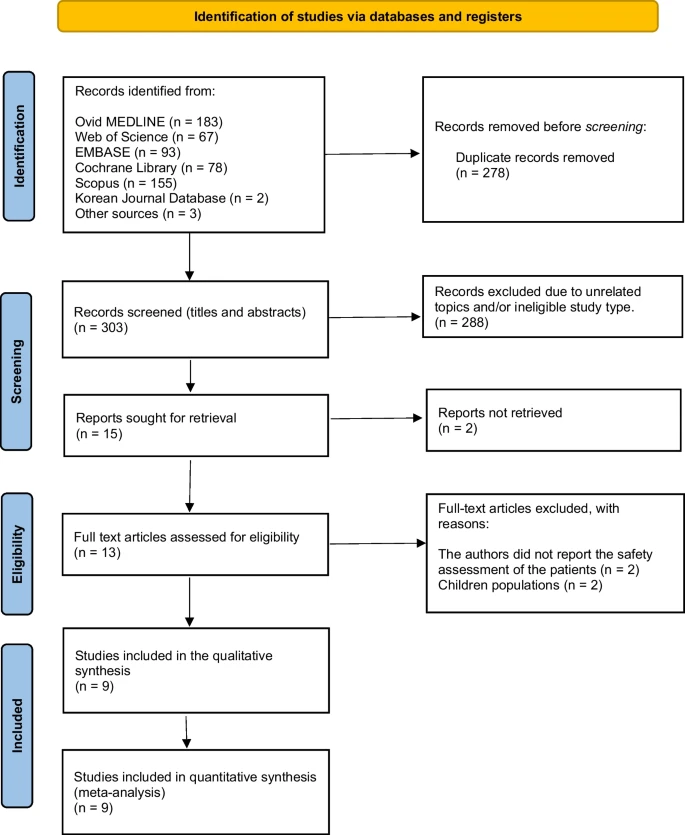
对本研究纳入的所有RCT的总体AE进行的荟萃分析显示,MSC组的AE发生率与对照组相比并无显著升高(图2)。
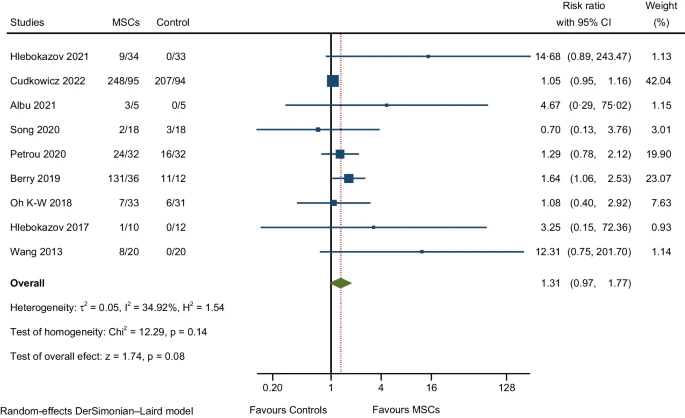
我们通过比较MSC组和对照组之间的总体AE发生率来评估异质性(图3);L’ Abbé图中的每个圆圈代表一个RCT,圆圈越大代表AE较多的RCT ;虚线对角线表示RCT中两组的总体AE发生率相等。
MSCs组 (0.23–57.27%) 和对照组 (0–85.19%) 的总体AE发生率存在显著差异。Cudkowicz等人在RCT中报告了MSCs组总体AE发生率最高 (57.27%)。另一方面,Hlebokazov等人在试验中观察到了MSCs组总体AE发生率最低 (0.231%)。
四项RCT报告了SAE;
- Cudkowicz等人报告了与疾病进展和与研究干预无关的其他原因相关的死亡;
- Petrou等人将SAE判定为MS复发和上呼吸道感染;
- Berry等人报告说所有SAE都与ALS疾病进展有关;
- Oh KW等人认为死亡是由于与疾病进展相关的呼吸衰竭和心脏骤停造成的。
汇总效应估计的荟萃分析显示,与对照组相比,MSCs组的SAE发生率无显著差异(图4)。
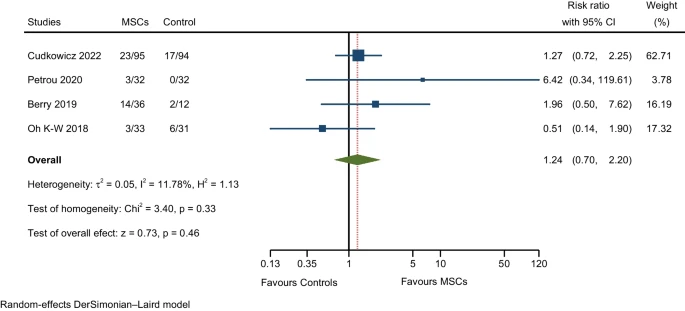
表2全面总结了安全性结果和安全性报告结果的质量。
| 安全结果 | RCT 数量* | 结果(RR;95% CI) | 异质性 I 2 |
|---|---|---|---|
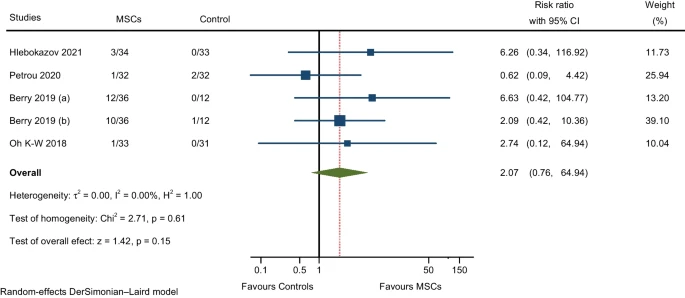
| 一般性疾病和给药部位情况 | 4/9 | 2.07(0.76-64.94) | 0.00% |
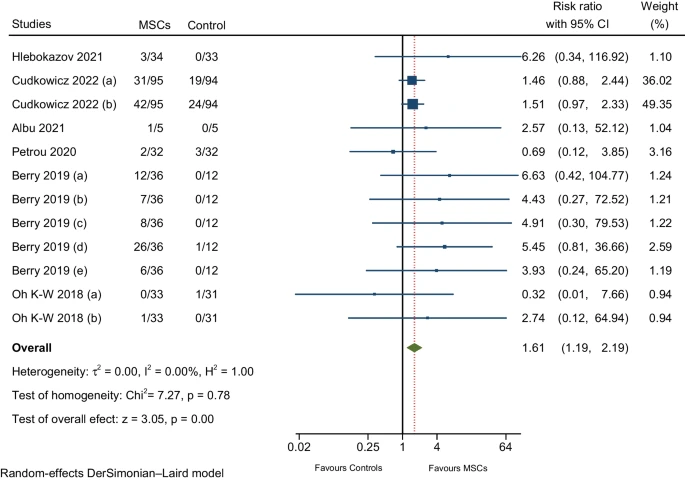
| 肌肉骨骼和结缔组织疾病 | 6/9 | 1.61(1.19-2.19) | 0.00% |
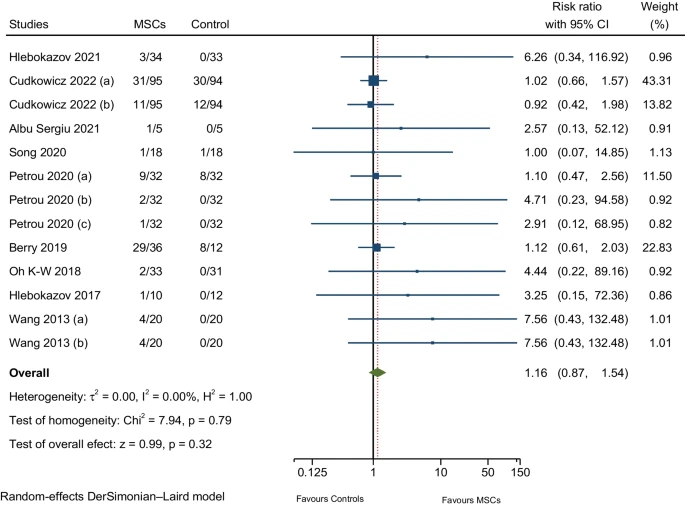
| 神经系统疾病 | 9/9 | 1.16 (0.87-1.54) | 0.00% |
| 感染和侵染 | 3/9 | 1.40(0.46-4.25) | 0.00% |
| 呼吸、胸腔和纵隔疾病 | 2/9 | 1.19(0.16-9.08) | 20.14% |
| 皮肤和皮下组织疾病 | 1/9 | 不适用 | 不适用 |
| 胃肠道疾病 | 4/9 | 1.07(0.63-1.83) | 0.00% |
| 损伤、中毒和手术并发症 | 3/9 | 1.07(0.85-1.34) | 0.00% |
| 心脏疾病 | 1/9 | 不适用 | 不适用 |
| 血管疾病 | 1/9 | 不适用 | 不适用 |
| 代谢和营养障碍 | 1/9 | 不适用 | 不适用 |
| 总计SAE | 4/9 | 1.24(0.70-2.20) | 11.78% |
| 不良事件总计 | 9/9 | 1.31(0.97-1.77) | 34.92% |
| 安全报告质量 | RCT 数量* | 发现 (%) | 不适用 |
| 监测不良事件的先验计划 | 9/9 | 100% | 不适用 |
*报告了不良事件的试验RCT随机对照试验,AE不良事件,SAE严重不良事件,NA不适用
系统器官类别 (SOC) 相关不良事件
与一般疾病和给药部位情况相关的不良事件
对报告了发烧(注射MSCs后24小时内)和疼痛(注射部位疼痛)的四项RCT进行的荟萃分析表明,与对照组相比,MSCs组的AE发生率略高,但不显著(图5)。
与肌肉骨骼和结缔组织疾病相关的不良事件
六项RCT的荟萃分析报告了以下不良事件:
(i) 四肢疼痛 – 上肢或下肢(四项RCT),
(ii) 背痛 – 非特异性、短期背痛(四项 RCT),
(iii) 关节痛(一项RCT),
(iv) 肌痛(一项RCT),
(v) 横纹肌溶解症(一项 RCT),
以及(vi) 颈部疼痛(一项RCT)。
对主要RCT的个体效应大小的汇总估计显示,与对照组相比,MScs组的显著不良事件发生率略高(图6)。
与神经系统疾病相关的不良事件
九项RCT报告了头痛(非特异性/体位性);一项RCT报告了肌肉无力;两项RCT报告了头晕;另一项RCT报告了面神经疾病(周围性面神经麻痹)。对神经系统疾病相关不良事件的汇总估计值的荟萃分析显示,MSCs组的发生率略高于安慰剂组,但差异并不显著(图7)。
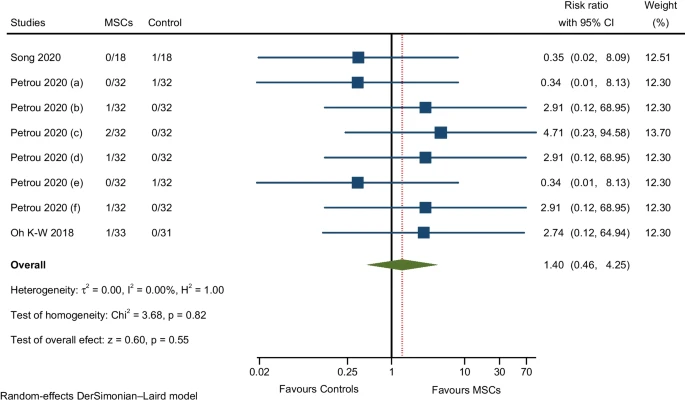
与感染和侵染相关的不良事件
三项RCT的荟萃分析报告了尿路感染(两项RCT)、病毒感染(一项 RCT)、上呼吸道感染(一项RCT)、鼻窦炎(一项RCT)、疥疮感染(一项RCT)、远端手臂感染(一项RCT)和肾脏感染(一项 RCT)的发生情况。效应大小的汇总估计显示MSCs组的不良事件发生率略高于对照组,但不显著(图8)。
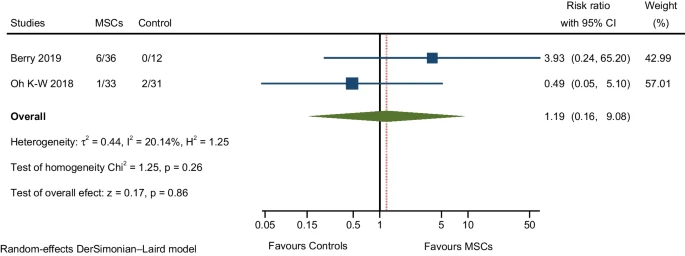
与呼吸、胸腔和纵隔疾病相关的不良事件
两项RCT报告了呼吸衰竭和咳嗽(均与疾病进展有关)。汇总分析发现MSCs组的AE发生率高于对照组,但两组之间的差异并不显著(图9)。
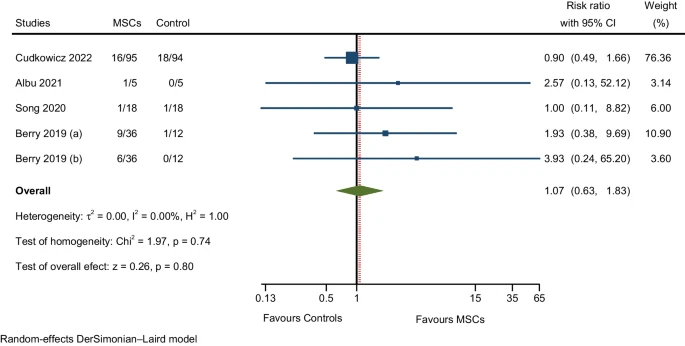
与胃肠道疾病相关的不良事件
4项RCT报告了恶心、呕吐、胃肠功能障碍和便秘等不良反应。荟萃分析结果显示,MSC组的不良反应发生率略高于对照组,但差异不显著(图10)。
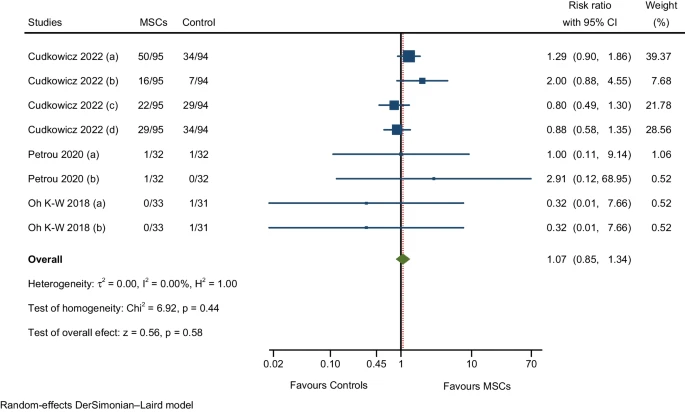
与损伤、中毒和手术并发症相关的不良事件
三项RCT的效应大小汇总估计显示,MSCs组的AE发生率并不显著高于对照组(图11)。三项RCT报告的AE包括手术疼痛、术后并发症、腰椎穿刺后综合征、跌倒、骨折(腿/手)和挫伤。
与心脏疾病相关的不良事件
一项RCT报告了心脏骤停(不认为与治疗相关)。
与血管疾病相关的不良事件
一项RCT报告了血肿(与手术或治疗无关)。
与代谢和营养障碍相关的不良事件
一项RCT报告了低钠血症(不认为与治疗相关)。
讨论
据我们所知,这项研究是第一篇总结鞘内注射间充质干细胞安全性特征的系统综述和荟萃分析,并支持旨在评估单剂量或多剂量鞘内注射间充质干细胞治疗的安全性和有效性的试验结果,在这些试验中,作者认为这种细胞给药途径对患有神经系统疾病的患者来说是一种潜在的安全治疗方法。
结论
总之,通过鞘内注射间充质干细胞导致与肌肉骨骼和结缔组织疾病相关的不良事件略有增加。然而,没有观察到严重不良事件,证实了先前临床试验的结果,表明鞘内注射间充质干细胞可能是神经系统疾病患者的安全给药途径。
由于小规模研究效应的证据有限,并且试验的交叉设计可能存在问题,因此未来的分析需要大样本量、设计良好的多中心RCT和长期随访。
参考资料:Mesa Bedoya, L.E., Camacho Barbosa, J.C., López Quiceno, L. et al. The safety profile of mesenchymal stem cell therapy administered through intrathecal injections for treating neurological disorders: a systematic review and meta-analysis of randomised controlled trials. Stem Cell Res Ther 15, 146 (2024). https://doi.org/10.1186/s13287-024-03748-7
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请及时跟本公众号联系,我们将在第一时间处理。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号