2型糖尿病 (T2DM) 是最常见的碳水化合物代谢紊乱疾病之一,以慢性高血糖和胰岛素抵抗 (IR) 为特征,已成为全球面临的紧迫健康挑战。
由于其自我更新、分化、免疫抑制和旁分泌特性,间充质干细胞已成为治疗各种人类疾病(包括代谢、心血管、神经退行性疾病和自身免疫性疾病)的非常有前途的治疗方式。有趣的是,人类间充质干细胞已被证明可通过改善肺功能和降低炎症生物标志物水平明显降低COVID-19患者的急性呼吸窘迫和死亡率。

间充质干细胞存在于大多数器官的结缔组织中,已从成人组织(如骨髓 (BM)、肺和脂肪)以及围产期组织(包括 AM、UC和胎盘)中成功获取。与成人组织分离的MSCs相比,围产期MSCs具有许多优势,包括但不限于免疫原性更低、增殖能力更强、分化潜力更大、容易获取和来源丰富。研究表明,人类脐带间充质干细胞对1型糖尿病 (T1DM) 患者的治疗效果优于BM衍生的MSCs 。
此外,研究表明,人类脐带间充质干细胞治疗可通过增强胰岛素敏感性、抑制炎症和改善肝脏糖脂代谢功能障碍,有效改善啮齿动物T2DM模型中的全身IR和高血糖。
来自脐带 (UC) 和羊膜 (AM) 等围产期组织的间充质干细胞 (MSC) 具有来源丰富、增殖能力强、免疫调节和可塑性强等优点,是治疗2型糖尿病的理想选择。然而,治疗2型糖尿病的最佳围产期MSC来源仍然难以捉摸。
羊膜与脐带间充质干细胞治疗2型糖尿病疗效对比分析
本研究旨在比较来自同一供体的羊膜和脐带 (AMMSCs和UCMSCs) 的间充质干细胞在缓解2型糖尿病症状方面的治疗效果,并探索其潜在机制。
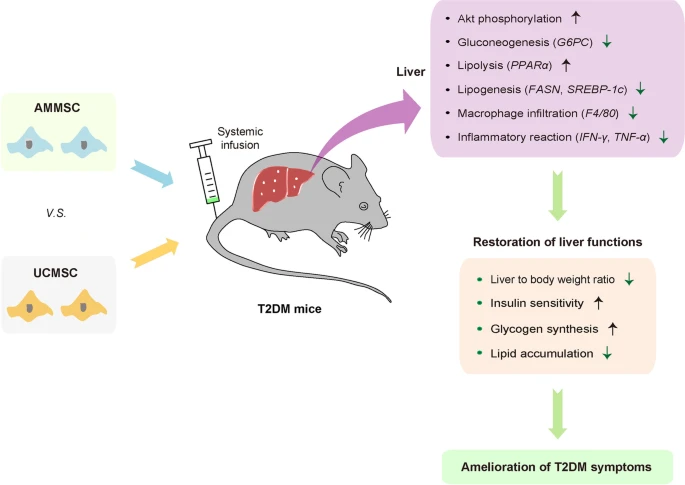
结果
间充质干细胞输注可缓解小鼠的高血糖症和胰岛素抵抗(IR)
为了比较羊膜间充质干细胞和脐带间充质干细胞输注对2型糖尿病的治疗效果,给7周龄雄性小鼠静脉输注单剂量羊膜间充质干细胞或脐带间充质干细胞。与盐水对照相比,接受脐带间充质干细胞输注的小鼠在注射后7天血糖水平显著降低,并且这种降血糖作用可持续5周(图1A)。
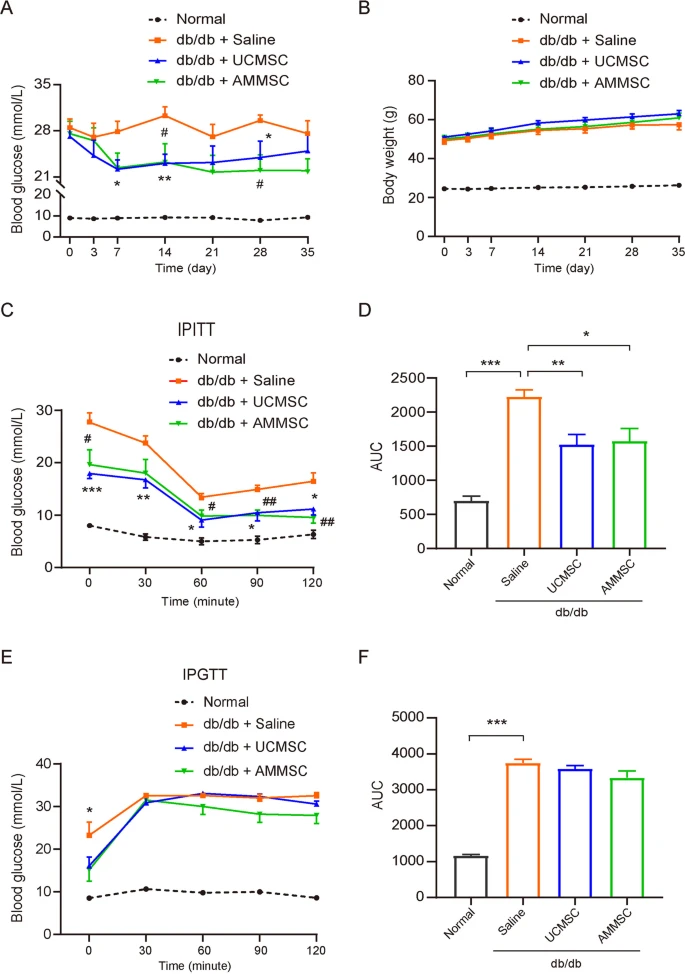
在指定时间点测定不同组小鼠的随机血糖浓度 (A) 和体重 (B)。不同组小鼠在MSC或盐水输注后两周的 IPITT血糖浓度(C) 和曲线下面积 (D) 变化。不同组小鼠在MSC或盐水输注后两周的IPGTT血糖水平 (E) 和曲线下面积 (F) 变化。
同样,羊膜间充质干细胞注射在小鼠中也产生了类似的降血糖效果(图1A)。
盐水注射和MSC注射的小鼠的体重没有差异(图1B)。
支持改善高血糖症的是,无论是羊膜间充质干细胞还是脐带间充质干细胞注射,都对小鼠的胰岛素敏感性和葡萄糖耐受性有很大益处(图1C-F)。
综上所述,这些发现表明,相同供体来源的羊膜间充质干细胞和脐带间充质干细胞可以对小鼠的高血糖和IR发挥相当的缓解作用。
间充质干细胞注射可减少小鼠肝脏中的脂质沉积并促进糖原合成
鉴于肝脏在调节糖脂代谢中的关键作用,我们随后探讨了MSC是否有益于小鼠的肝功能。与盐水对照相比,羊膜间充质干细胞和脐带间充质干细胞均降低了小鼠的肝脏与体重的比率(图2A)。
相反,羊膜间充质干细胞或脐带间充质干细胞注射对EWAT与体重的比率没有影响(图2B)。AMMSC或脐带间充质干细胞输注均可大大恢复小鼠肝脏的糖原储存能力(图2C和D)。
同时,与盐水对照相比,羊膜间充质干细胞和脐带间充质干细胞均显著减少了小鼠肝脏脂质滴的数量(图2E和F)。
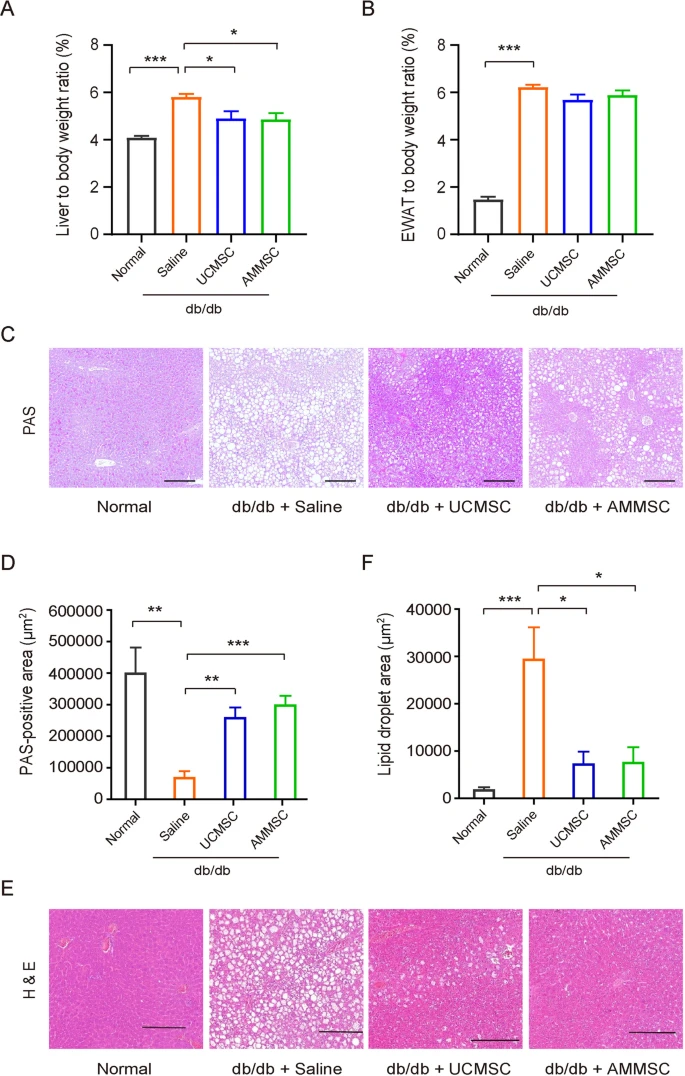
在MSC或盐水输注五周后,计算了不同组小鼠的肝脏与体重的比率(A)和EWAT与体重的比率(B)。(C)不同组小鼠肝脏切片中PAS染色的代表性图片。比例尺=200μm。(D)不同组小鼠肝脏中PAS阳性区域的量化。(E) 小鼠肝脏切片中 H&E 染色的代表性图片。比例尺=200μm。(F)不同组小鼠肝脏中脂滴区域的量化。
这些结果表明,输注相同的供体来源的羊膜间充质干细胞和脐带间充质干细胞可对小鼠的肝脏糖脂代谢产生类似的改善。
间充质干细胞输注增强Akt磷酸化并改善小鼠肝脏中的糖脂代谢功能障碍和炎症
由于在MSC注入的小鼠中观察到了肝脏保护作用,我们特别关注肝脏,以探索羊膜间充质干细胞和脐带间充质干细胞的上述抗糖尿病作用背后的细胞和分子机制。为了进一步支持胰岛素敏感性的改善,MSC注入的小鼠肝脏中的胰岛素信号传导得到增强,与注射盐水的小鼠相比,Akt的磷酸化增加证明了这一点(图3A和B)(补充图1)。
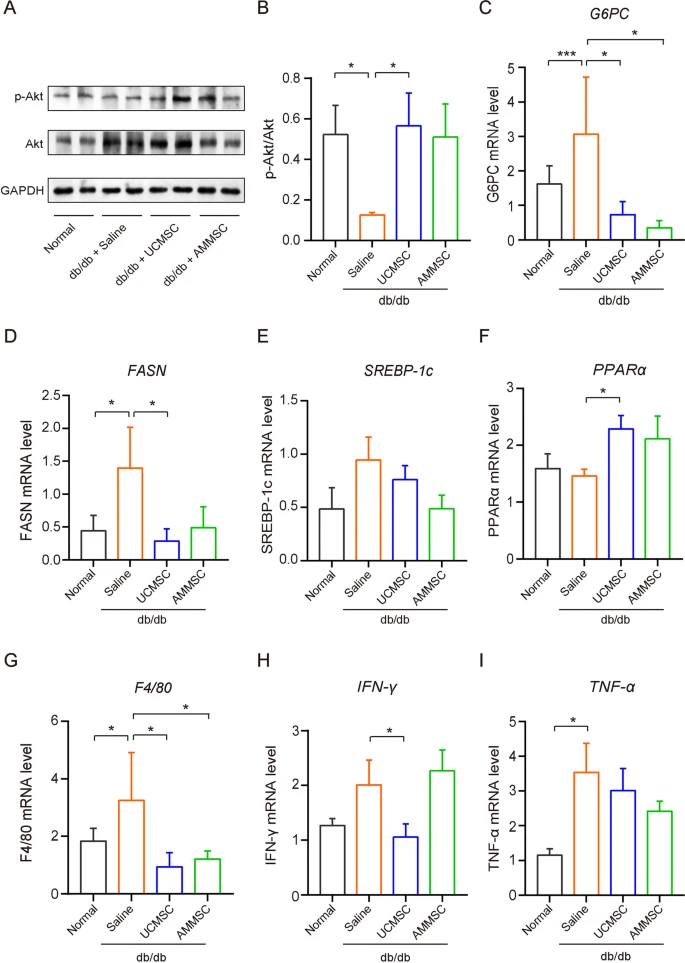
与肝糖原储存和胰岛素敏感性增加一致,与盐水对照相比,MSC注射的小鼠的肝脏中葡萄糖-6-磷酸酶(G6PC)(一种关键的糖异生基因)的mRNA表达水平显着降低(图3C)。
与MSCs治疗的小鼠肝脏脂质积累急剧减少 (图4E和F)一致 ,与注射盐水的小鼠相比,注射MSCs的小鼠肝脏中脂肪生成基因脂肪酸合酶(FASN) 和固醇调节元件结合蛋白1 ( SREBP-1) 的mRNA表达水平降低 (图3D和E )。
相比之下,注射MSCs的小鼠肝脏中关键脂肪分解基因过氧化物酶体增殖激活受体α ( PPARα )的 mRNA水平显著上调 (图3F)。
讨论
我们的结果表明,AMMSCs和UCMSCs表现出难以区分的免疫表型和多谱系分化潜能,但UCMSCs的扩增能力远高于AMMSCs。此外,我们发现单剂量静脉注射AMMSC或UCMSC可以同样降低2型糖尿病小鼠的高血糖并改善 IR。机制研究表明,AMMSC或UCMSC输注可以大大改善小鼠肝脏中的糖脂代谢,这表现为肝重比降低、脂质积累减少、糖原合成上调和Akt磷酸化增加。
无论是羊膜间充质干细胞还是脐带间充质干细胞给药都可以通过增强全身胰岛素敏感性和降低高血糖来同等程度地缓解T2DM症状。
总之,这些数据表明,相同供体来源的 AMMSC和UCMSC具有可比的效果,并且在缓解2型糖尿病症状方面具有相似的保肝机制。
结论
综上所述,我们发现单剂量静脉注射相同供体来源的羊膜间充质干细胞和脐带间充质干细胞对小鼠的严重T2DM症状(包括高血糖和全身IR)具有类似的改善效果。
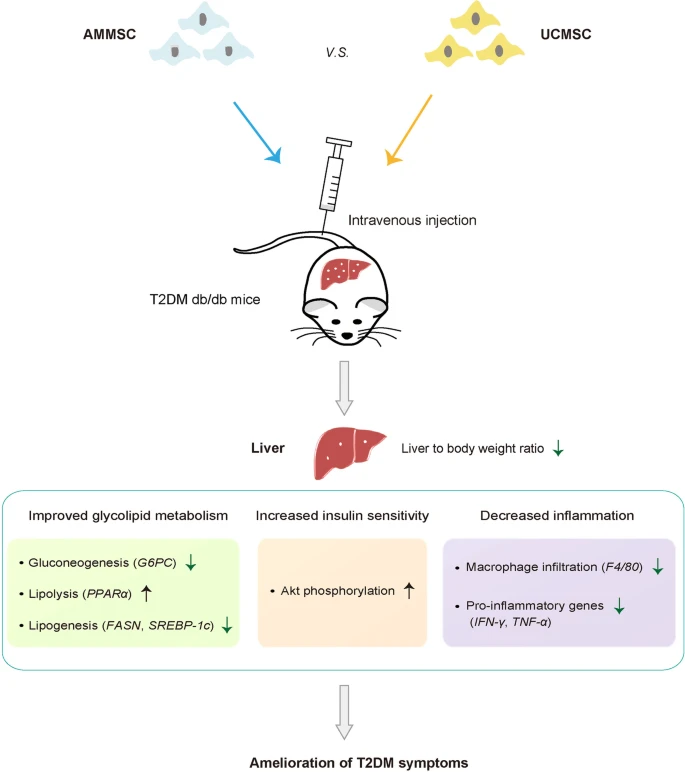
羊膜间充质干细胞和脐带间充质干细胞的这些类似的抗糖尿病益处可归因于小鼠的糖脂代谢改善、胰岛素敏感性增加和肝脏炎症减少(图4)。
单剂量静脉输注来自同一供体的AMMSCs或UCMSCs可通过改善糖脂代谢、增强胰岛素敏感性和减少肝脏炎症来缓解小鼠的2型糖尿病症状。
参考资料:Wang, Z., Li, H., Fang, J. et al. Comparative Analysis of the Therapeutic Effects of Amniotic Membrane and Umbilical Cord Derived Mesenchymal Stem Cells for the Treatment of Type 2 Diabetes. Stem Cell Rev and Rep 18, 1193–1206 (2022). https://doi.org/10.1007/s12015-021-10320-w
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号