宫腔粘连 (IUA),也称为Asherman综合征,是一种由子宫基底层受损引起的子宫内膜纤维化的病症,导致子宫腔部分或全部粘连。IUA通常伴有月经量减少,严重时会出现继发性闭经。此外,IUA会影响胚胎着床和发育,导致宫腔容积减少甚至完全消失,导致女性不孕和反复流产。
然而,正常的子宫内膜在修复过程中不会留下疤痕。在子宫操作和炎性细胞因子的影响下,子宫内膜参与缺氧,减少新生血管,并控制粘附相关细胞因子的表达。

宫腔粘连的发病机制
IUA经常因宫腔手术而进展。院长等人对1856例宫腔粘连患者进行了回顾性分析,发现67%的刮宫是诱导或自发的,而22%是由于产后出血。克里斯蒂娜等人认为产后催乳素水平升高和雌激素水平降低会产生拮抗作用;因此,子宫内膜更容易萎缩。此外,IUA与炎性细胞因子有关。
Mo等人的实验结果表明IUA患者的术前炎症明显高于非IUA患者。目前,唯一确认的引起IUA的感染因素是生殖器结核。研究表明结核分枝杆菌感染宫腔可导致子宫内膜组织局灶性溃疡、坏死或出血,而子宫内膜破坏可导致部分或完全IUA。
另一个重要原因是子宫内膜血液灌注不足。例如,子宫动脉栓塞、B-Lynch缝合、宫腔镜子宫肌瘤切除术等。由于子宫内膜长期供血不足,难以再生,增加了IUA的可能性。图1)。

目前,宫腔粘连的免疫机制尚不清楚,赵等认为与阴道菌群和微生态失衡有关。微生态失衡的原因可能与长期使用抗生素、频繁性交、阴道潮红、雌激素减少有关。这些因素大大增加了子宫炎症的发生率。
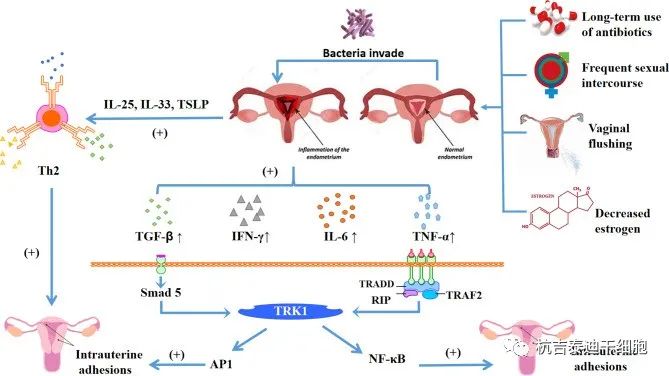
微环境中的破环使细菌更容易侵入,受损的子宫内膜产生炎症反应。一方面可释放炎性细胞因子IL-25、IL-33、TSLP,激活辅助Th2细胞,促进子宫内膜纤维化。另一方面,还可释放炎性细胞因子TGF-β、IFN-γ、IL-6、TNF-α等。其中,TGF-β可通过TGF-β-Smad5途径,而TNF-α和NF-κB共同促进子宫内膜纤维化,从而形成宫腔粘连。
目前修复宫腔粘连的方式有哪些
目前,临床常用的治疗方法是经宫颈粘连切除术(TCRA)。为了提高IUA的疗效,可以先插入宫内节育器和宫内球囊。宫内节育器和球囊可以扩张狭窄的宫腔,改善患者的远期预后。此外,我们还可以增加生物屏障,例如新型交联透明质酸凝胶、自交联透明质酸凝胶和雌激素凝胶。然而,IUA的预后仍不理想。一些研究人员假设IUA的复发程度与粘连程度有关。
此外,粘连的释放还需要促进子宫内膜纤维化的再生和修复。由于干细胞的再生能力,研究人员正在考虑使用干细胞进行治疗。研究表明载有人脐带间充质干细胞的胶原蛋白支架可促进子宫内膜结构重建和功能恢复(表格1)。


近年来,间充质干细胞 (MSCs) 因其在免疫调节方面的巨大潜力和在组织再生上发挥的治疗功能而受到了全世界的关注。间充质干细胞可以迁移到组织损伤的区域以促进免疫调节、分泌抗炎细胞因子,重建或促进伤口的愈合。
间充质干细胞治疗宫腔粘连的机制及应用
间充质干细胞免疫:目前的研究表明,骨髓间充质干细胞的应用可以通过抑制先天性和适应性免疫系统来促进子宫内膜再生。
间充质干细胞的分化治疗:间充质干细胞具有分化能力 间充质干细胞到达组织后,分泌SCF、M-CSF等干细胞细胞因子,重新激活受损组织内源性干细胞的分化潜能,从而促进新组织细胞的产生替换受损细胞,导致组织恢复;这被称为干细胞分化疗法。
目前,MSC分化已应用于各个领域。Ashman综合征的一组临床治疗资料显示接受自体CD9+ , CD44+ , CD90+的患者骨髓间充质干细胞移植经历了子宫内膜血管化的改善和子宫内膜厚度的增加。一名这样的患者随后接受了体外受精和胚胎移植,并成功地将胎儿带到了足月。
干细胞旁分泌疗法:间充质干细胞通过释放可溶性旁分泌细胞因子来协调组织恢复。通过旁分泌途径治疗IUA是目前最流行的研究方法,因为IUA部分受炎性细胞因子的影响。炎性细胞因子的一个亚组是MSCs的急性炎性旁分泌作用中的IL-1ra。IL-1ra抑制辅助T 淋巴细胞系统的细胞因子刺激,以及以IL-1ra依赖性方式在巨噬细胞中产生炎性细胞因子TNF-α。
干细胞的归巢特性:干细胞的归巢功能通过破坏组织分泌的趋化因子系统来招募干细胞。众所周知,趋化因子SDF1及其特殊受体CXCR4在BMSCs的归巢中起关键作用。此外,研究表明,ERα通过SDF1/CXCR4促进BMSCs的增殖和迁移。此外,CXCL12/CXCR4蛋白配体是一种趋化因子受体复合物,可以将干细胞传递到子宫,从而促进子宫内膜修复。
干细胞移植治疗宫腔粘连临床研究进展
临床试验一:2011年,一项案例研究报道了在妊娠8周时将自体骨髓间充质干细胞植入子宫腔的严重IUA患者。
2014年的一项研究发现,严重AS患者注射CD34+或培养的自体骨髓基质细胞后,子宫内膜厚度略有增加。

临床试验二:2016年的案例研究报道了子宫螺旋动脉注射自体外周血CD133+细胞对16例难治性不孕症患者子宫内膜重建的影响。同年,7例重度IUA患者接受了自体经血基质细胞移植,其中2例成功受孕。

在以前的研究中,将骨髓/胶原复合物移植到重度IUA患者体内有助于治疗后实现妊娠和活产。我们最近证明,自体脂肪间充质干细胞(ADSCs)和凝胶结合可以通过BMP7-Smad5通路增加子宫内膜厚度,减少纤维化面积,从而成功受孕。
临床试验三:2022年,中南大学湘雅医院在一项研究中,共招募了10名患者:6名患有宫腔粘连,4名患有剖宫产瘢痕憩室。所有患者均在子宫内两次注射人脐带间充质干细胞。除了胸片、心电图和腹部超声外,还通过血常规、肝肾功能、卵巢功能、肿瘤生物标志物和免疫功能等多项实验室检查来评估干细胞移植后的安全性。此外,基于3D超声成像的子宫内膜厚度、子宫体积和剖宫产瘢痕憩室显示了干细胞移植的疗效。

结果:我们发现这些入组患者在细胞注射前后所有这些实验室测试的结果都是正常的。同时,治疗过程中胸片、心电图结果也正常。腹部超声显示,一名患者在细胞治疗后左右肾脏大小不一致,而其他患者则正常。此外,子宫内膜厚度、子宫体积、剖宫产瘢痕憩室均有改善趋势,但无明显差异。
结论:总之,子宫内注射临床分级的人脐带间充质干细胞对于子宫损伤后愈合不良是安全的。
截止2022年11月5日,在美国国立卫生研究院的最大临床试验注册库clinicaltrials.gov网站上注册的有关干细胞治疗宫腔粘连的临床研究项目有6项。
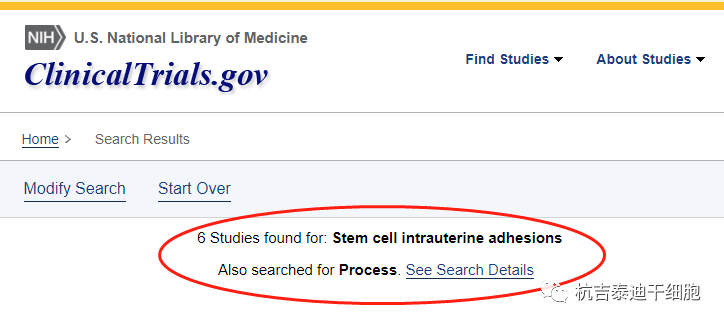
其中五项是来自中国,干细胞临床研究备案机构(医院)分别为:
- 浙江大学医学院附属第二医院,浙江
- 南京鼓楼医院
- 上海同济医院
- 邵逸夫爵士医院,浙江大学医学院,
- 南京鼓楼医院
- 白俄罗斯国家科学院生物物理与细胞工程研究所
未来展望
宫腔粘连(IUA)是影响女性不育的重要因素。间充质干细胞的再生能力可用于修复和恢复纤维化子宫内膜的功能。
近年来,干细胞移植技术临床发展给宫腔粘连的治疗带来了突破,已经成功帮助一些不孕患者实现了生育的愿望。目前,国内干细胞技术在治疗宫腔粘连领域处于领先地位。相信未来,干细胞治疗宫腔黏连会取得更大的进展。
参考资料:
Chen JM, Huang QY, Zhao YX, Chen WH, Lin S, Shi QY. The Latest Developments in Immunomodulation of Mesenchymal Stem Cells in the Treatment of Intrauterine Adhesions, Both Allogeneic and Autologous. Front Immunol. 2021 Nov 15;12:785717. doi: 10.3389/fimmu.2021.785717. PMID: 34868069; PMCID: PMC8634714.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号