慢性肾病 (CKD) 是一种全球性的健康问题,与年龄相关的肾功能损害有关,糖尿病、高血压、心脏病和肾功能衰竭家族史等多种风险因素会加剧这种损害。无论病因如何,肾纤维化(或因对肾损伤的伤口愈合反应失败而导致的瘢痕形成)是CKD的最终常见表现,并且是导致终末期肾功能衰竭 (ESRD) 的肾实质破坏的关键因素),这是一种使人衰弱的疾病,需要透析或肾移植作为最后的手段。
通常,慢性肾病早期可见尿液中出现大量泡沫、尿中见血色或夜尿增多,即尿常规中出现尿蛋白(+)和红细胞(+),则可能为预警信号。
慢性肾病分期
慢性肾脏病(CKD)定义为长期(大于3个月)发生的肾脏损害,导致肾功能逐渐下降,临床表现为估计肾小球滤过率(eGFR;<60mL/min/1.73m2)和蛋白尿(通过>30mg/g的白蛋白与肌酐比测量)。
已经建立了一个分级系统,根据GFR将CKD患者分为五类(G1、G2、G3a、G3b、G4和G5),每个后续类别代表肾功能恶化的一个阶段,其中G5是最虚弱的阶段,定义为终末期肾病(ESKD)。此外,与白蛋白肌酐比 (ACR) 相关的子类别也被纳入当前的CKD分类中。表格1)。G期和/或A期的增加与合并症和肾衰竭的风险增加有关。
表格1:使用GFR和ACR类别对CKD进行分类。
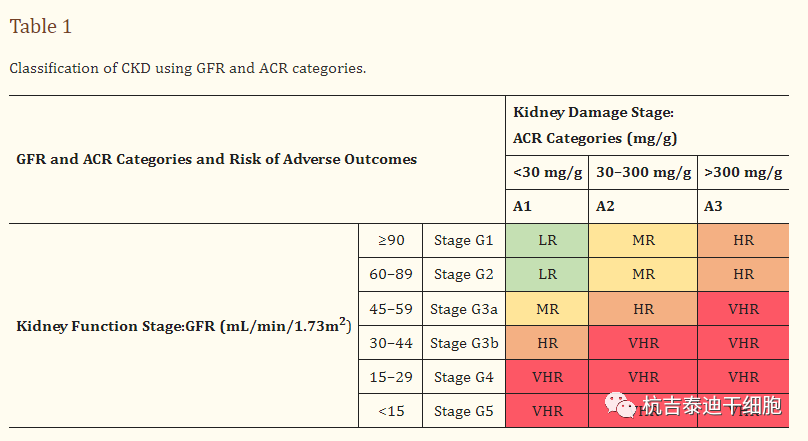
慢性肾病的五个阶段,从最轻微的形式(绿色阴影)到最严重的形式(红色阴影)。缩写:LR,低风险;MR,中等风险;人力资源,高风险;VHR,非常高的风险。
目前治疗慢性肾病的主要方法
目前CKD患者的治疗选择有限。CKD的管理主要是对症的(通过降低血压 (BP) 或血糖水平和/或控制血胆固醇以降低心脏病风险等方法来减轻症状或预防与CKD相关的并发症的发展)。然而,没有一种治疗能有效阻止CKD向ESKD的进展,因此对肾脏替代治疗的需求很高。严重的预期发病率和死亡率、巨额的CKD医疗保健支出以及缺乏有效的治疗强调了开发新的干预措施以防止其发展为ESKD以及与透析和/或器官移植相关的社会经济负担的必要性。
近年来,干细胞作为当今医学领域的热点研究方向,为受损组织器官提供了修复再生的可能,这种治疗方式也得到了越来越多的关注。
尤其是骨髓来源的间充质干细胞 (BM-MSCs) 已被确定为慢性肾病的一种有前途的治疗方法,因为它们具有免疫调节特性和分泌介导抗凋亡、有丝分裂、血管生成、抗细胞凋亡的营养因子。组织修复中的氧化和基质重塑效应,并且具有良好的安全性。已在多项临床试验的CKD患者中得到证实。
间充质干细胞治疗慢性肾病的潜在机制
尽管发现外源递送的骨髓间充质干细胞通过直接植入和转分化重新填充受伤的肾小管上皮细胞,但最近的证据表明,骨髓间充质干细胞对肾脏保护作用主要以旁分泌方式介导,通过分泌营养因子和免疫调节。现在人们了解到,骨髓间充质干细胞的治疗效果主要是通过释放这些可溶性因子来介导的,这些可溶性因子与局部微环境密切相互作用,调节炎症、纤维化和缺氧反应,作为促进组织修复和再生的一种方式。
骨髓间充质干细胞分泌的抗凋亡和促有丝分裂生长因子,如肝细胞生长因子(HGF)、胰岛素样生长因子(IGF-1)、血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)-II 、基本神经生长因子、表皮生长因子 (EGF) 和血小板衍生生长因子 (PDGF),都被发现有助于受伤部位的细胞增殖。骨髓间充质干细胞还释放血管生成(如VEGF、血管生成素-1和单核细胞趋化蛋白 (MCP)-1)和趋化因子,通过促进血管生成和血管生成进一步帮助受损组织恢复。这些因子还通过分泌ECM和细胞粘附蛋白介导ECM重塑,并调节基质降解MMP的活性(图3)。

在渗入受损组织后,BM-MSCs与内皮内衬的各种粘附分子相互作用,以确保它们定位到受损部位。原发性损伤部位释放化学引诱物SDF-1和HA,它们分别与BM-MSCs表面上的CXCR4和CD44结合,以增强其归巢。局部微环境含有许多由损伤区域释放的促炎因子(如IL-1β和TNF-α),它们与toll样受体激活一起,对BM-MSCs的启动和激活至关重要。一旦被激活,BM-MSCs会释放多种营养因子并介导免疫调节作用,以解决组织炎症并促进结构和功能损害。
总之,通过可溶性营养因子的分泌和免疫调节,骨髓间充质干细胞将整体免疫从促炎性Th1/Th17驱动的免疫反应转变为更具抗炎性的Th2/Treg谱,从而中断延长的炎症阶段并刺激细胞增殖和组织重塑的进展,这对于慢性损伤器官的功能恢复至关重要。
间充质干细胞疗法治疗慢性肾病有效吗?临床试验有哪些?
间充质干细胞治疗慢性肾病的临床前证据
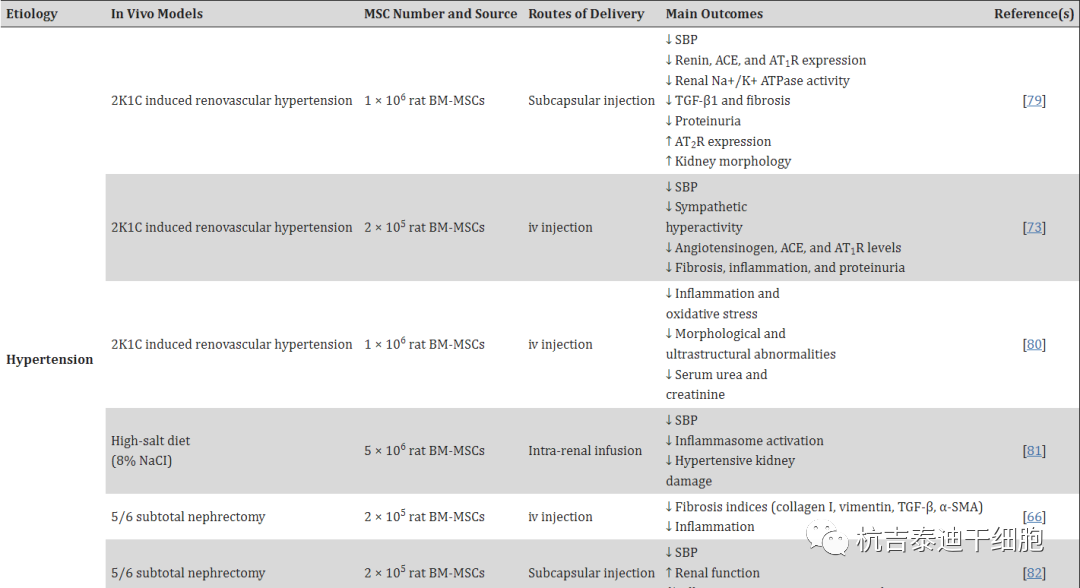
几项体内研究已经证实,骨髓间充质干细胞可以阻止甚至逆转实验性CKD某些阶段的进展,这可以通过临床使用的功能标志物的显著改善来表明,包括血浆肌酐、血浆尿素、尿蛋白水平的降低和/或GFR增加(表2)。这些功能改变部分由骨髓间充质干细胞的抗纤维化作用解释,这已在CKD的几种正常血压和高血压模型中得到证实。
值得注意的是,骨髓间充质干细胞的抗纤维化作用可能与其抗炎特性重叠,它们的抗纤维化作用模式似乎分为四个主要类别,其中两个是(i)免疫调节和(ii ) 抑制TGF-β1活性。

间充质干细胞治疗慢性肾病的临床试验
根据clinicaltrials.gov,目前有45个正在进行或完成的临床试验评估间充质干细胞治疗各种病因引起的慢性肾病的安全性和有效性。其中,本文仅讨论了使用骨髓间充质干细胞治疗慢性肾病的研究(见表3)。

间充质干细胞治疗慢性肾病:一项为期18个月随访的安全性研究

2018年,在一项I期、单臂、开放标签临床试验(ClinicalTrials.gov ID:NCT02195323)中,7名因高血压、肾病综合征或不明原因患有CKD的合格参与者接受了单剂量2×106自体骨髓间充质干细胞并在细胞移植后随访18个月。
本研究的主要目的是调查骨髓间充质干细胞在CKD患者中的安全性。尽管与测量的基线水平相比,骨髓间充质干细胞治疗患者的eGFR或血清肌酐未观察到显著变化,但自体骨髓间充质干细胞显示出有希望的安全性,因为在18个月内未报告与细胞相关的不良事件随访期。
间充质干细胞治疗多囊肾病的安全性和耐受性临床研究

在对6名患有晚期常染色体显性多囊肾病 (ADPKD) (eGFR: 25-32 mL/min/1.73m2 ) 的患者 (ClinicalTrials.gov ID: NCT02166489 )进行的另一项I期探索性研究中获得了类似的结果,其中给药在12个月的随访期间,自体骨髓间充质干细胞与任何不良事件无关。
间充质前体细胞 (MPC)移植治疗糖尿病肾病的安全性及有效性研究

鉴于上述骨髓间充质干细胞已确立的安全性,同一组进行了一项多中心、随机、双盲、剂量递增的安慰剂对照试验(ClinicalTrials.gov ID:NCT01843387),其中30名中度至重度参与者糖尿病肾病患者随机接受单次静脉输注同种异体骨髓间充质干细胞(150×106细胞或300×106细胞)或安慰剂,并在治疗后随访60周。
没有报告与输注相关或被认为与治疗相关或针对供体细胞产生特异性抗HLA抗体的严重不良事件。功效分析仅显示在骨髓间充质干细胞输注后12周有改善eGFR的趋势,该趋势在60周的研究期间保持不变。测试的两种剂量显著改善测量的终点参数,包括第12周时的尿白蛋白、白蛋白-肌酐或蛋白-肌酐比、肌酐清除率、血脂谱和糖化血红蛋白 (HbA1c) 水平,证明骨髓间充质干细胞在糖尿病肾病治疗中具有临床应用价值。
目前干细胞治疗慢性肾病需要克服的主要问题
总之,迄今为止各种临床试验的结果表明,干细胞治疗慢性肾病具有良好的安全性和公认的免疫抑制作用。表3)。尽管如此,在将外源性扩增的间充质干细胞用于临床应用时,仍应考虑一些潜在风险,包括
- 1、过度免疫抑制引起的机会性感染风险;
- 2、对移植细胞产生免疫原性反应的风险;
- 3、异位组织形成 ;
此外,迄今为止进行的大多数临床试验仅评估了通过iv给药间接应用骨髓间充质干细胞,而不是通过肾内 (ir) 给药直接进入肾脏,这可能会削弱骨髓间充质干细胞在肾脏内的功效,因为大多数静脉注射的细胞最初通过循环迁移到肺部在到达损伤部位之前。因此,未来需要进行比较直接与间接运用间充质干细胞治疗慢性肾病的安全性和有效性的试验。
未来展望:肾脏疾病是肾组织的慢性损伤,会引发冠心病,心衰,脑卒中等全身性疾病,传统治疗方法很难扭转疾病进程。近年来,越来越多的研究成果表明,间充质干细胞在慢性肾病的治疗发挥了作用,越来越多的临床试验证实了干细胞治疗慢性肾病的有效性和安全性,这也为肾脏疾病的治疗打开了全新的思路。
未来,随着临床研究的进一步开展,干细胞有望成为肾脏疾病的临床新选择。
参考资料:Li Y, Ricardo SD, Samuel CS. Enhancing the Therapeutic Potential of Mesenchymal Stromal Cell-Based Therapies with an Anti-Fibrotic Agent for the Treatment of Chronic Kidney Disease. Int J Mol Sci. 2022 May 27;23(11):6035. doi: 10.3390/ijms23116035. PMID: 35682717; PMCID: PMC9181689.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号