在过去的几十年中,针对各种疾病和损伤状态的干细胞治疗研究取得了重大进展;由于近年来公众对干细胞的旺盛需求导致世界各地不受监管的“再生诊所”增加,这些诊所提供未经证实的质量和来源未知的干细胞疗法,可治疗数百种疾病和病症。
然而,正如Alofisel(武田)最近在欧洲获得批准所表明的那样,我们开始看到药物级干细胞疗法的出现。正在进行适当的对照研究,以确定干细胞疗法是否是许多疾病和损伤状态的可行治疗选择。这篇综述的重点是临床前啮齿动物研究和间充质干细胞治疗出血性中风的临床试验的现状。

近年来,间充质干细胞已被广泛研究用于治疗缺血性中风;然而,他们对出血性中风的研究较少。尽管如此,已有超过10年的临床前研究调查了间充质干细胞治疗出血性中风的方法,并证明了该疾病的一系列动物模型的功能改善。间充质干细胞的治疗用途可以修复或再生受损的神经元细胞,并可以减少继发性神经炎症级联反应,从而改善患者的预后。
间充质干细胞治疗出血性中风的临床前研究
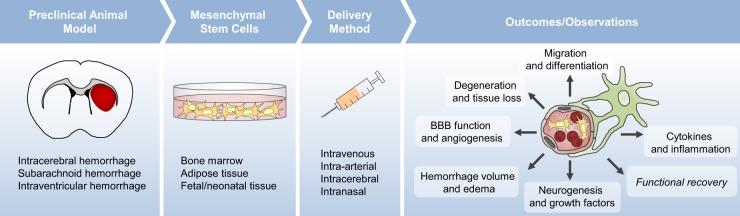
干细胞治疗出血性脑卒中动物模型的研究(表格1; 如图1) 已经研究了十多年。这些研究中有超过一半使用人类来源的间充质干细胞治疗颅内出血,其余研究来自大鼠。大约60%的MSCs来自骨髓 (BM-MSCs),因为这是人类和大鼠的可行来源,而脐带/胎盘/羊膜来源的细胞用于大约四分之一的研究,其余的来源于脂肪组织 (AT-MSCs)。后一种来源均来自人体组织。
MSCs的递送方法也各不相同,不到一半的研究使用立体定向引导的脑内注射,紧随其后的是静脉内给药,然后是动脉内和鼻内给药。虽然每剂量的MSC数量范围很广,从1×105到8×106个细胞,但它们往往会根据递送方法分成两组。通过脑内注射递送的MSCs的平均剂量为每只大鼠6.4×105个细胞(范围,1×105至5×106细胞),而静脉注射MSCs的平均剂量高出四倍,每只大鼠2.6×106个细胞(范围,1×106至8×106个细胞)。
| 源码 | 物种 | 行程模型 | 剂量、给药和时间 | 结果 | 参考 |
|---|---|---|---|---|---|
| 人类,骨髓 | 雄性Wistar大鼠(270–320 克) | 将100µl 自体全血注入右侧纹状体 | 3×106、5×106和 8 × 10 6细胞,通过尾静脉注射,ICH 后一天 | NSS 的改进;减少纹状体组织损失;新形成的未成熟神经元的存在 | 58 |
| 大鼠,骨髓 | Sprague-Dawley 大鼠(270–300 g),性别未知 | VII 型胶原酶进入左尾状核 | 2×106个细胞,通过颈动脉/颈静脉/侧脑室注射,在 ICH 后第 1、3、5 和 7 天 | 改善肢体运动功能 | 30 |
| 人类,脂肪 | 雄性 Sprague-Dawley 大鼠(200–220 克) | VII 型胶原酶进入纹状体 | 3 × 106个细胞,通过 IV 注射,ICH 后 24 小时 | 改进肢体放置行为评分;减少脑萎缩和神经胶质增生;内皮标记物表达但不表达神经元或神经胶质标记物;急性脑炎症标志物 | 64 |
| 人类、加工过的脂肪抽吸物(或脂肪来源的) | 雄性Wistar大鼠 (422±28.9 g) | IV型胶原酶进入尾状核 | 3×106个细胞,通过尾静脉注射,ICH后24小时 | 旋转棒测试的改进;无病变大小差异;内源性祖细胞增加 | 31 |
| 人类,骨髓 | 雄性Wistar大鼠(270–320 克) | 将100µl自体全血注入右侧纹状体 | 1×106 个细胞,通过颈内动脉注射,ICH后24小时 | 单独使用 MSC 治疗(仅与甘露醇联合使用)对 NSS 和转弯测试没有改善;无纹状体组织丢失;新形成的未成熟神经元的存在 | 32 |
| 人类,脐带 | 雄性 Sprague-Dawley 大鼠(230–260 克) | VII 型胶原酶进入纹状体 | 2 × 10 5 个细胞,脑内注射,ICH 后 24 小时 | mNSS 和 Morris 水迷宫测试的改进;受伤面积明显减少;血管密度增加;ICH 周围区域退化神经元数量减少;免疫反应减弱 | 33 |
| 人类脐带 * 具有成纤维细胞生长因子和肝细胞生长因子 (HGF) 的基因转导 | 雄性 Sprague-Dawley 大鼠(平均 220 g) | 胶原酶进入内囊 | 6 × 10 5 个细胞,脑内注射,ICH 后一周 | 旋转棒测试的改进;脱髓鞘减少 | 34 |
| 人类,骨髓 | 雄性食蟹猴 (4.2 ± 0.2 kg) * 首次出现在灵长类动物中 | 1.5 mL 右皮层和基底神经节之间的自体动脉血 | (1–5) x 10 6 个细胞,通过脑内注射,ICH 后 1 周或 4 周 | 改良的 Kito 评分量表的改进;减少组织损伤;更高的微血管密度 | 51 |
| 大鼠,骨髓(过度表达 GDNF) | Wistar 大鼠(270–320 g),性别未知 | I 型胶原酶 (0.25 U) 和 1 U 肝素钠注入右侧纹状体 | 5×105 个细胞,脑内注射,ICH 后 3 天 | mNSS 的改善;病变体积缩小 | 65 |
| 大鼠,骨髓 | 雌性 Wistar 大鼠(275–300 克) | 0.3mL 血液进入蛛网膜下腔*第一个 SAH 模型 | 3×106个细胞,通过尾静脉注射,SAH 后 24 小时 | mNSS 的改善;增殖细胞数量增加;更少的凋亡细胞 | 48 |
| 大鼠,骨髓 | 雌性 Wistar 大鼠(200–250 克) | IV型胶原酶进入纹状体 | 2×106 个细胞,脑内注射,ICH 后 2 小时 | 增强的内源性神经发生;减少新生神经细胞的凋亡 | 47 |
| 大鼠,骨髓 | 雄性 Sprague-Dawley 大鼠(270–320 克) | VII型胶原酶进入纹状体 | 1 × 10 6 个细胞,通过尾静脉注射,ICH 后一小时 | mNSS 的改善;减少出血量;存在新形成的未成熟神经元;升高的 BDNF | 35 |
| 人类,脂肪 | 雄性 Sprague-Dawley 大鼠(200–250克) | VII型胶原酶进入纹状体 | 1 × 106个细胞,通过右侧股静脉注射,IHC 后 24 小时 | mNSS 的改进 | 36 |
| 人类,脐带 | 雄性 Sprague-Dawley 大鼠(产后第 4 天 – 体重未知) | 200µL新鲜母体全血心室(每个心室 100µL) | 1 × 105个细胞,脑内注射,ICH 后 24 小时 | 预防 PHH 的发展;负趋地性试验和旋转棒试验的减值减弱;减少胼胝体损失;增加星形胶质细胞增生;炎性细胞因子表达增加 | 59 |
| 人类,骨髓 | 雄性 Sprague-Dawley 大鼠(190–210 克) | VII型胶原酶进入纹状体 | 2 × 10 5 个细胞,脑内注射,ICH 后 1 天 | mNSS 的改善;脑水含量下降;ICH 周围区域的中性粒细胞浸润和小胶质细胞活化减少;炎症介质的下调 | 37 |
| 大鼠,骨髓 | 雌性 Wistar 大鼠(200–250 克) | IV型胶原酶 (0.5 IU) 进入纹状体 | 5 × 10 6 个细胞,脑内注射,ICH 后 2 个月 | 改进 Rotarod 和 Video-Tracking-Box 测试;增加内源性神经发生 | 38 |
| 大鼠,骨髓 | 雌性 Wistar 大鼠(275–300 克) | 未肝素化的血液进入蛛网膜下腔 | 3 × 10 6 个细胞,通过尾静脉注射,ICH 后 24 小时 | 改善脑组织结构完整性(电子显微镜) | 68 |
| 大鼠,骨髓 | 雄性 Sprague-Dawley 大鼠(250–300 克) | IV型胶原酶 | 3 × 10 6 个细胞,通过静脉注射,ICH 后两小时 | 减少脑水肿和血脑屏障渗漏;促炎细胞因子水平降低;细胞凋亡减少;下调 ICH 部位小胶质细胞/巨噬细胞和中性粒细胞浸润的密度;减弱 ONOO- 形成;ZO-1 和 claudin-5 水平升高 | 67 |
| 人类,脐带 | 雄性 Sprague-Dawley 大鼠(250–300 克) | VII型胶原酶进入纹状体 | 5×105个细胞,脑内注射,ICH后2天 | 旋转棒测试的改进;减少病变体积;增加血管生成;减少炎症因子 | 66 |
| 人类,沃顿氏胶质(脐带)* 72 小时后进入神经元样细胞 | 雄性 Sprague-Dawley 大鼠,(240–280 克) | IV型胶原酶进入纹状体 | 2×105 个细胞,脑内注射,ICH后1 周 | 旋转棒和肢体放置试验的改进;增加血管密度; 致敏细胞中 GDNF 增加 | 43 |
| 大鼠,骨髓*缺氧预处理 | 雄性 C57BL/6 小鼠(25–28 克) | IV型胶原酶 | 1×106个细胞,通过鼻内递送,IHC 后 3 天和 7 天 | mNSS、Rotarod 试验、脱胶试验和运动功能评估的改进;减少组织损失;减少心室扩大;获救的生长因子水平;增强增殖和数量未成熟的神经元 | 45 |
| 大鼠,骨髓 | 雄性自发性高血压大鼠,未知体重 | 50µL自体血 | 1×106个细胞,尾静脉注射,时间未记录 | 改进 mNSS 和改进的肢体放置测试;减弱血脑屏障通透性;紧密连接相关蛋白 occludin 和 IV 型胶原水平增加 | 52 |
| 人脐带 *带血肿抽吸 | 雄性Sprague-Dawley大鼠(250–280 克) | IV型胶原酶进入尾状核 | 1 × 10 5通过脑内注射,ICH 后 6 小时(血肿抽吸) | mNSS 的改善;血肿周围 p53 表达减少 | 44 |
| 人类脐带*比较 IV 和 IC 给药 | 雄性Sprague-Dawley大鼠(230–260克) | VII型胶原酶进入纹状体 | 2 × 10 5 个细胞通过脑内注射。通过尾静脉注射2 × 10 6 个细胞 – 时间未记录 | mNSS 的改善;减少伤害量;脑内给药组血管密度增加 | 46 |
| 人类,羊膜 | 雄性Wistar大鼠(240–260 克) | VII型胶原酶进入纹状体 | 5×105 个细胞,脑内注射,ICH后24 小时 | mNSS 的改善;增加血管密度; 细胞凋亡减少;增加神经元的增殖和分化;增加生长因子水平;减少中性粒细胞浸润和小胶质细胞活化 | 39 |
| 大鼠,骨髓* 与条件培养基相比 | 雄性 Sprague-Dawley大鼠(250–280克) | 将100µl自体动脉血注入右基底神经节 | ICH后立即通过尾静脉注射,未报告剂量。 | 前肢放置、转弯测试和 mNSS 的改进;对 Morris 水迷宫性能没有影响;减少脑水含量;增加下游信号分子的磷酸化;炎性细胞因子减少 | 56 |
| 大鼠,骨髓* 含第二信使信号抑制剂 | 雄性大鼠(250–280克) | 将100µl自体动脉血注入右基底神经节 | ICH 后 1 小时和 24 小时通过 IV 注射未报告剂量。 | 改善被抑制剂治疗阻断的 mNSS;抑制剂减弱第二信使信号 | 57 |
| 大鼠,骨髓 | 雄性自发性高血压大鼠 (250–300g) | 20µl血红蛋白进入右尾状核 | 1 × 10 6 个细胞,脑内注射,ICH后 6 小时 | 改进 mNSS 和改进的肢体放置测试;减少脑水含量;细胞凋亡减少;增加 ZO-1 染色;减少小胶质细胞活化;炎性细胞因子减少 | 40 |
| 人类骨髓*MSCs 预防动脉瘤破裂 | 雄性C57BL/6 J 小鼠,体重未知 | 脱氧皮质酮醋酸盐诱导全身性高血压。弹性蛋白酶进入右基底池 | 1 × 106个细胞,静脉注射,动脉瘤诱导后6天和9 天 | 降低动脉瘤破裂的发生率和破裂率 | 50 |
| 人类,胎盘来源 | 雄性Sprague-Dawley大鼠(250–350克) | IV型胶原酶进入纹状体 | 1×106个细胞,通过尾静脉注射,ICH后一小时 | 降低死亡率;减少血肿体积和心室扩大;减少脑水肿;增加 ZO-1 和occludin | 41 |
| 大鼠,骨髓 | 雄性Wistar大鼠(300–350 克) | 威利斯环穿孔 | 1.5×106 个细胞,通过鼻内递送,SAH后6天 | 改善感觉运动和机械感觉功能;减少灰质和白质损失;星形胶质细胞和小胶质细胞的激活增加 | 61 |
干细胞移植治疗出血性脑中风的临床研究
截至目前工有13个与干细胞治疗出血性脑中风相关的项目登记在美国clinicaltrials.gov网站,其中已经发表了6篇关于已完成试验和病例系列的研究文章,从9名患者到100名患者不等,报告的患者总数为164例(女性占39.6%;治疗组中有106名患者)文献(表2)。
与临床前研究一样,使用了一系列来源来获得MSC。骨髓来源的MSCs,和脐带来源的MSCs是临床试验中最常用的。还使用了含有MSC的骨髓来源的单核细胞,并测试了嗅鞘细胞 (OEC)、神经祖细胞 (NPC)、UC-MSC和雪旺细胞 (SC) 的联合细胞移植。
| 患者人数 | 干细胞类型 | 中风亚型 | 剂量、给药和时间 | 跟进 | 功能结果和副作用 | 参考 |
|---|---|---|---|---|---|---|
| 12名患者(包括6名对照组) 4 名女性(均为MSC组) 8名男性,20-60岁 | 自体骨髓间充质干细胞 | 2(出血),4(缺血) | 50–60×106个细胞,通过静脉注射,中风后3个月至1年 | 8周和 24周 | 在8周和24周时,所有临床评分(FM和BI)和功能成像参数均无改善;无不良事件 | 73 |
| 10名患者,无对照组,6名女性, 4名男性,42-87岁 | 联合嗅鞘细胞 (OEC)、神经祖细胞 (NPC)、脐带间充质细胞 (UCMSCs) 和雪旺细胞 (SC) | 6(脑梗塞),4(出血) | OEC:1×106,OEC+NPC:1-2×106和2-4×106,NPC:2-5×106,NPC + SC:2-5×106和2×106, UCMSCs:1–2.3×107,通过颅内实质植入(perilesion)(OEC、NPC)、鞘内植入(NPC、SC)和静脉内给药(UCMSCs),卒中后6个月至20年 | 6 个月 – 2 年 | 改善神经功能,包括改善言语、肌肉力量、肌肉紧张、平衡、疼痛和呼吸;增加 BI 分数和临床神经功能损伤量表分数;无不良事件 | 75 |
| 100名患者(包括40名对照组),40名女性,60名男性,35-74岁 | 自体骨髓单核细胞,包括间充质干细胞 | ICH(手术引流和开颅减压术) | 7.25×105至1.35×106/LMSCs(注射 3.5毫升),通过颅内引流管(基神经节),ICH后5-7天 | 6个月 | 改善NIHSS和BI分数;5名治疗组患者出现低烧(3 天),无需干预即可自行消退;1例患者治疗4个月后确诊为肺癌 | 76 |
| 24名患者(包括8名对照组),8名女性,16名男性,38-58岁 | 自体骨髓单核细胞7例,同种异体脐带单核细胞9例 | 出血 | 1.8×108个BM细胞,通过颅内给药进入血肿腔,出血后2周和3周 | 3、6、12、36 和 60 个月 | 用于脑组织愈合的计算机断层扫描 (CT) 扫描显示出更好的结果;NIHSS、mRS 和改进的 BI 的改进;无不良事件 | 74 |
| 9名患者(包括4名对照组),4名女性, 5名男性,41-59岁 | 自体骨髓间充质干细胞 | ICH | ICH后>1年,两次(间隔4周)每次静脉输注4.57× 107个MSC,相当于每公斤体重8.54× 105个 | 12、16、24、36和 60周 | 改善运动障碍和认知障碍;两组患者明显的临床改善具有可比性;无不良事件 | 77 |
| 9名患者, 3名女性, 6名男性,24-30周龄 | 人脐带来源的间充质干细胞小时数 | IVH | 3例患者接受5×106, 6例患者接受 1×107,诊断后7天内通过脑室内给药 | 2、4、6 和 8 周 | 安全可行;无不良事件 | 72 |
总体而言,几乎所有组都报告没有副作用。治疗后长达5年的患者随访表明该疗法具有良好的耐受性,试验报告几乎没有不良事件,也没有患者新发肿瘤的迹象。
结论
时间、剂量和给药途径都是出血性中风实验性干预的变量,需要适当考虑、控制并在理想情况下进行测试。由于干细胞可能作为炎症反应的调节剂而不是持续出血的减少剂,因此在血肿有效停止扩大后的第一个24小时之后,递送可能是最佳的。
需要进行特定于干预的剂量范围研究以确定理想剂量,这可能不是最大耐受剂量,并且要测试的给药途径在该患者群体中应该是可行的。由于血肿减压通常不推荐手术,通过静脉输液或其他非侵入性途径间接靶向血肿病变将具有吸引力。
最后,超过10年的临床前研究广泛证明了间充质干细胞疗法在实验性出血性中风中的有效性。此外,针对人类出血性中风患者的小型病例研究和系列研究表明,间充质干细胞治疗可改善功能恢复。鉴于出血性中风的破坏性影响及其影响的数百万患者,开发这种疗法供人类使用的动力是可以理解的。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号