国家药监局:我国近一百个干细胞产品正在开展药物临床试验
2024年5月14日
5月8日,国家药监局党组成员、副局长黄果率队前往北京,深入调研细胞和基因治疗产品的研发情况。此次调研旨在了解该领域的最新进展,并就政策引导、研发质量等方面进行探讨,推动该领域产业高质量发展。 据了解,细胞和基因治疗产品已成为全球医药...
干细胞药物批准最新消息:浙江、江苏、广东、吉林各新增一款IND
2024年3月8日
近期,国家药品监督管理局药品审评中心公开受理了四款干细胞新药,它们分别是来自浙江生创精准医疗科技有限公司的“宫血间充质干细胞注射液”(受理号:CXSL2400156)、江苏得康生物科技有限公司的“异体人源脂肪间充质干细胞注射液”(受理号:CXSL24001...
上海干细胞公司, 干细胞治疗药物药监局(IND)受理品种信息
2023年7月13日
中国前沿上海有一些生物医药科技公司正在积极探索干细胞治疗药物的研发和应用。有的已经向药监局提交了新药申请(IND),并已被受理。这些公司包括博品骨德生物医药科技(已迁出)、上海爱萨尔生物科技、上海慧存医疗科技、上海莱馥医疗科技、上海泉生生...
针对膝骨关节炎,中国首个干细胞药物正式进入III期临床试验
2023年4月3日
西比曼生物科技(Cellular Biomedicine Group, CBMG)今日正式宣布,启动公司旗下异体人源脂肪间充质祖细胞注射液AlloJoin®的 III 期临床试验。已完成的随机、双盲、对照的多中心II期临床试验结果(96周随访)初步表明,AlloJion®在治疗...
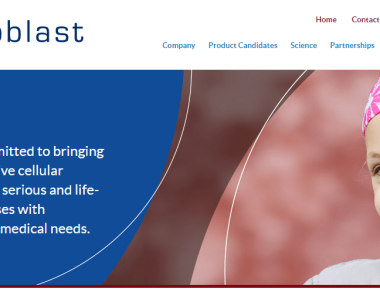
全球首个!间充质干细胞药物上市获FDA受理
2023年3月9日
3月9日,细胞治疗先驱企业Mesoblast宣布,其间充质干细胞疗法Remestemcel-L的上市申请(BLA)已经获得FDA受理,用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者。(全球首个!间充质干细胞药物上市) Remestemcel-L是一款骨髓来源间充质...
中国干细胞药物注册申报进展(2023年1月)
2023年2月2日
2023年1月1日至1月31日,国内新增2家企业的2款干细胞药物临床试验申请获得受理;新增2款干细胞药物通过默示许可。 截至2023年1月31日,国内共有41家企业(不含子公司)的58款干细胞药物临床试验申请获得受理,共有28家企业(不含子公司)的44款获准默...
2023年度干细胞药物申报或迎来更大爆发!
2023年2月1日
随着全球细胞与基因治疗产业迈入了高速发展期,当前全球已登记的细胞与基因治疗相关临床试验已超过7000余项,其中近3000项已完成临床试验研究,并进行了数万例干细胞移植。 添加图片注释,不超过 140 字(可选) 国内干细胞药物注册也正处在蓬勃发...
中国干细胞药物注册申报和受理进展
2023年1月9日
撰文:何斌来源:医学参考报● ● ● 2022年12月1日至12月31日,国内新增1家企业的1款干细胞药物临床试验申请获得受理;新增2款干细胞药物通过默示许可。 截至2022年12月31日,国内共有41家企业的56款干细胞药物临...
盘点:2022年国内干细胞药物IND获批情况汇总
2023年1月6日
干细胞科技作为一种新兴生物技术,正在引领一场新的颠覆性医学技术革命。 截至2022年12月31日,国内共有57款干细胞药物临床试验申请获得国家药品监督管理局药品审批中心(CDE)受理,其中43款获得临床试验默示许可,已经进入或即将进入临床试验阶...










 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号