概述:急性肝衰竭(ALF)是一种严重的肝病综合征,病情迅速恶化,死亡率很高。肝移植是最有效的治疗方法,但供体肝脏的缺乏和移植费用的高昂限制了其广泛应用。近年来,ALF的治疗一直没有突破,干细胞在ALF治疗中的应用是一个重要的研究领域。
间充质干细胞(MSCs)因其来源丰富、免疫原性低、无伦理限制等优点被广泛应用于疾病治疗研究。虽然MSCs对治疗ALF有效,但MSCs在ALF中的应用还需要进一步研究和优化。在这篇综述中,四川大学华西医院感染性疾病中心陈恩强教授讨论了间充质干细胞治疗急性肝衰竭的潜在机制,总结了一些增强间充质干细胞疗效的方法。

介绍
急性肝衰竭(ALF)是一种严重的肝病综合征,病情迅速恶化,死亡率很高。治疗ALF的第一步是去除病因,如戒酒、抗肝炎病毒、停用伤肝药物等。ALF的主要治疗方法包括常规药物治疗、人工肝支持系统和肝移植。肝移植是最有效的治疗方法,但供体肝脏的缺乏和移植费用的高昂限制了其广泛应用。近年来,ALF的治疗一直没有突破,干细胞在ALF治疗中的应用是一个重要的研究领域。同时,干细胞有助于治疗多种疾病,包括肝功能衰竭、肝纤维化、移植物抗宿主病、2型糖尿病等。
干细胞是一类具有自我复制、高增殖和多向分化潜能的细胞,可以通过免疫调节、组织修复等多种方式发挥治疗作用。间充质干细胞(MSCs)因其来源广泛、免疫原性低、无伦理限制等优点被广泛应用于疾病治疗研究。先前的研究表明,MSCs通过分化为肝细胞样细胞 (HLC)、调节免疫细胞和分泌治疗因子来治疗ALF。虽然MSCs治疗ALF有效,但MSCs在ALF中的应用还需要进一步研究和优化。在这篇综述中,我们讨论了MSCs治疗ALF的潜在机制,总结了一些增强MSCs疗效的方法,并探索了MSCs移植的最佳途径。

干细胞治疗急性肝衰竭的作用机制有哪些?
陈恩强教授:其实对于肝衰竭、尤其是ALF,是否常规使用干细胞治疗,目前学者们尚未达成一致观点。有些专家认为,ALF是一种预后凶险的疾病,其临床特点是起病和进展迅速,目前的治疗方案还是倾向于首选基本的支持治疗,必要时采取肝移植治疗;而干细胞治疗的疗效发挥需要时间,起效较慢可能会限制该疗法的临床应用。但也有专家提出,不能完全否定干细胞治疗,该疗法的丰富作用机制使其具有很好的发展前景。
众所周知,ALF是一个以炎症反应为主的肝细胞损伤过程。最初的大量炎性细胞因子释放以及由此引起的级联反应可导致全身炎症反应综合征,随后出现代偿性抗炎反应,导致免疫细胞功能障碍、败血症和多器官功能障碍。目前的研究显示,干细胞治疗急性肝衰竭也不仅是通过细胞或组织重建来发挥效果的,更多的是通过肝脏局部发挥免疫调节作用来发挥肝脏治疗效应。
研究表明,干细胞不仅分泌多种免疫调节因子,还可抑制转化分泌肝细胞生长因子,以及IL-1、IL-6等促炎症因子释放,促进组织再生以及抗纤维化;干细胞治疗通过分泌细胞因子激活肝卵圆细胞、促进肝细胞再生作用,抑制了免疫反应和炎症反应,促进的肝脏组织器官的修复和内源性肝脏干细胞的增殖,为肝细胞的修复提供了很好的环境。
此外,干细胞治疗的效用可能不仅局限在肝脏坏死时的“急性治疗”,在治疗恢复期时,也可辅助其他治疗,减少肝纤维化、肝硬化等的发生。
基因编辑或预处理以修饰间充质干细胞
MSCs治疗ALF的有效性已得到证实,但如何提高其疗效值得进一步研究。研究报道,编辑MSCs的一些靶基因可以增强ALF的有效性,已验证的靶基因包括c-Met、CC基序趋化因子受体2(CCR2)、CXC基序趋化因子受体4(CXCR4)、肝细胞核因子4α (HNF4α)、IL-35、HGF、白细胞介素-1受体拮抗剂(IL-1Ra)、叉头盒A2(Foxa2)、VEGF等。过度表达某些趋化因子(c-Met、CCR2、CXCR4)的MSCs较多有可能到达损伤的肝脏,提高ALF的治疗效果。
蔡等发现Foxa2在MSCs中的过表达增强了肝细胞样分化并减轻了ALI。VEGF的过表达增强了MSCs的多能性并促进了MSCs在肝脏中的归巢和定植。
在MSCs移植前对MSCs进行不同刺激的预处理可能会提高ALF的治疗效果。实验采用的预处理方法包括依达拉奉、IL-1β、肿瘤坏死因子-α(TNF-α)、血清等。依达拉奉提高MSCs的抗氧化水平,可通过增加MSCs的归巢,促进增殖,显着提高肝组织修复能力,减少细胞凋亡,增加HGF的分泌。聂等报道了IL-1β (20 ng/mL) 预处理可以通过增加CXCR4的表达和提高MSCs治疗ALF的疗效来增强MSCs的归巢能力。张等发现 TNF-α (1ng/mL) 预处理的MSCs可以分泌治疗性外泌体来抑制巨噬细胞中NLRP3的激活,从而改善ALF。
间充质干细胞的联合治疗
事实上,MSCs联合其他疗法可能比单独使用MSCs疗法对ALF有更好的结果。经血MSCs可通过抑制Toll样受体4(TLR4)介导的PI3K/Akt/mTOR/IkappaB激酶(IKK)信号通路减轻肝损伤。同时,腺苷A2A受体 (A2AR) 激动剂可以与经血MSCs协同作用。
桑等发现MSCs移植联合IL-1Ra(2mg/kg)可显着提高ALF猪的存活时间,这可能与MSCs与IL-1Ra协同调节炎症和细胞凋亡有关。在ALF大鼠中,人脐带血MSCs移植联合粒细胞集落刺激因子可通过抑制炎症、氧化应激和肝细胞凋亡,促进MSCs的增殖和定植,减轻肝损伤。
在肝功能衰竭患者的MSCs临床试验中,常规药物治疗是基础,MSCs主要用作辅助治疗。人工肝支持系统是治疗肝衰竭必不可少的手段,其中血浆置换是常用的方法。在乙型肝炎病毒相关的ACLF (HBV-ACLF) 患者中,MSCs联合血浆置换在治疗后30、60和90天的死亡率和不良结局最低。然而,差异无统计学意义。
探索间充质干细胞治疗肝衰竭的最佳方案
表1总结了MSCs在ALF动物模型中的应用和疗效研究,以探索MSCs治疗ALF的最佳方案。
MSCs的组织来源广泛,包括骨髓、脂肪组织、脐带、胎盘、扁桃体等,目前尚不清楚不同组织来源的MSCs对ALF的治疗效果是否相似。扎雷等。报道,在ALF小鼠的肝酶、组织病理学和存活率方面,脂肪来源的MSCs比骨髓MSCs更有益。此外,有学者发现来自同一供体的不同围产期组织的MSCs在ALF小鼠中表现出不同的治疗作用。脐带-胎盘连接处来源的MSCs和胎盘来源的MSCs可以提高ALF小鼠的存活率,但脐带膜来源的MSCs与对照组无差异。
因此,MSCs的组织来源可能会影响ALF的疗效。值得注意的是,人源性MSCs在ALF动物模型中也具有显着疗效,反映出MSCs的低免疫原性。
| MSC类型 | 路线 | 剂量(移植频率) | 移植时间 | 诱导剂 | 动物 | 治疗作用及机制 | 参考 |
|---|---|---|---|---|---|---|---|
| 人骨髓间充质干细胞 | 门静脉 | 3×10 6 /kg(1次注射) | 使用 D-GalN 后立即注射 | D-GaN | 猪 | 存活率↑;炎症↓;δ 样配体 4 (DLL4)↑ | 81 |
| AT-间充质干细胞 | 外周静脉或脾静脉 | 2×10 6 /kg(2次进样) | 使用 CCL 4后第 3 天和第 8 天注射 | 覆铜板4 | 小狗 | 肝酶↓;(IL-1、IL-6、IL-8、IFN-γ)↓;(IL-4、IL-10、HGF 和 VEGFA)↑ | 82 |
| 骨髓间充质干细胞 | 外周静脉 | 1×10 6 /大鼠(1次注射) | 使用 TAA 后 12 小时注射 | TAA | 老鼠 | 存活率↑;内毒素↓; (IL-6和TNF-α)↓ | 89 |
| AT-间充质干细胞 | 外周静脉 | 2×10 5 /大鼠(1次注射) | 使用 APAP 后 2 小时注射 | APAP | 老鼠 | 肝酶↓;(TNF-α, MCP-1, IL-1β, ICAM-1 and phospho-JNK)↓; (细胞周期蛋白 D1 和 PCNA)↑ | 80 |
| hUCMSCs | 外周静脉 | 2×10 6或4×10 6 /大鼠(1次注射) | 使用 LPS/D-GalN 后 1 小时注射 | LPS/D-GaN | 老鼠 | 肝酶↓;(TNF-α、IFN-γ、IL-6、IL-1β)↓;肝细胞生长因子↑;(Notch、IFN-γ/Stat1、IL-6/Stat3)↓ | 78 |
| hUCMSCs | 外周静脉 | 5×10 5 /小鼠(1次注射) | 使用 APAP 前后 30 分钟注射 | APAP | 老鼠 | 肝酶↓;(谷胱甘肽、超氧化物歧化酶)↑;(TNF-α和IL-6)↓;肝细胞生长因子↑ | 90 |
| 间充质干细胞 | 外周静脉 | 2×10 6 /小鼠(1次注射) | 使用 ConA 或 APAP 后 30 分钟注射 | ConA 或 APAP | 老鼠 | 肝酶↓;(INF-γ和TNF-α)↓;Galectin-1 是 T-MSC 的关键效应物 | 79 |
| hPMSCs | 门静脉或外周静脉 | 1×10 8 /猪(1次注射) | 使用 D-GalN 后 18 小时注射 | D-GaN | 猪 | 肝酶↓;(肝脏炎症、肝变性和坏死)↓;(肝脏再生)↑ | 77 |
MSCs的移植途径包括外周静脉、门静脉、脾静脉、肝动脉、肝内注射、脾内注射等。
经尾静脉和肝内注射移植的MSCs在ALF大鼠肝功能和存活率方面具有相似的疗效。布特拉等显示尾静脉注射MSCs比腹腔注射更有效地减轻肝损伤。同样,从肝动脉、门静脉和尾静脉移植的MSCs对ALF有相似的治疗作用,而腹腔注射的MSCs对ALF没有治疗作用。然而,一些研究表明,门静脉给药比其他移植途径更有效。通过门静脉移植的MSCs比通过外周静脉移植的MSCs可以更好地减少肝脏炎症并促进肝脏再生。同时,门静脉注射在改善肝功能、抑制肝细胞凋亡、延长存活时间等方面优于肝动脉、外周静脉和肝内注射等其他MSCs移植途径。由于目前证据不足,ALF间充质干细胞移植的最佳途径仍不清楚。
用于MSCs移植的细胞剂量在大型动物(例如狗和猪)中与体重成比例增加,而在小型动物(例如小鼠和大鼠)中则固定不变(表1)。ALF进展较快,因此多数研究采用单个MSCs移植,移植时间越早越好(表1)。
一项研究比较了干细胞移植前30分钟和注射APAP后30分钟的疗效差异,发现早期治疗组在提高存活率和降低肝酶方面均高于延迟治疗组。
间充质干细胞治疗肝衰竭的临床试验
许多研究已经证明MSCs可以有效治疗动物模型中的ALF。同样,MSCs在临床试验中对肝功能衰竭患者也有治疗作用。
在一项随机对照试验中,外周输注同种异体骨髓间充质干细胞对HBV相关ACLF患者安全有效,并通过改善肝功能和降低严重感染的发生率显着提高24周生存率。
在Peng进行的一项临床试验中等,经肝动脉单次自体骨髓间充质干细胞移植2至3周后,患者的白蛋白、总胆红素和凝血酶原时间显着改善。然而,在192周的随访中,MSCs移植并没有为肝衰竭患者提供生存获益。MSCs治疗肝功能衰竭的过程尚不确定。
贾等发现将治疗时间从4周延长至8周可提高MSCs治疗终末期肝病的疗效。值得注意的是,延长疗程可能会增加治疗费用和不良反应的发生率。有趣的是,有学者发现肝功能衰竭患者的年龄是影响MSCs疗效的一个因素。事实上,如何选择适合MSCs治疗的肝功能衰竭患者需要引起更多的关注。
结论
MSCs通过分化为HLCs、调节免疫细胞和分泌治疗因子来治疗ALF(图1)。MSC可分化为HLC体内和体外, 但只有一小部分MSCs可以分化为HLCs体内, 以及将MSCs诱导成HLCs体外不会提高ALF的治疗效果。因此,HLCs在治疗ALF中并不起主导作用,治疗ALF也没有必要用HLCs。值得注意的是,MSCs介导的免疫调节是可塑的,MSCs在不同刺激下可以表现出促炎或抗炎表型。了解MSC在各种刺激条件下的免疫调节作用至关重要。
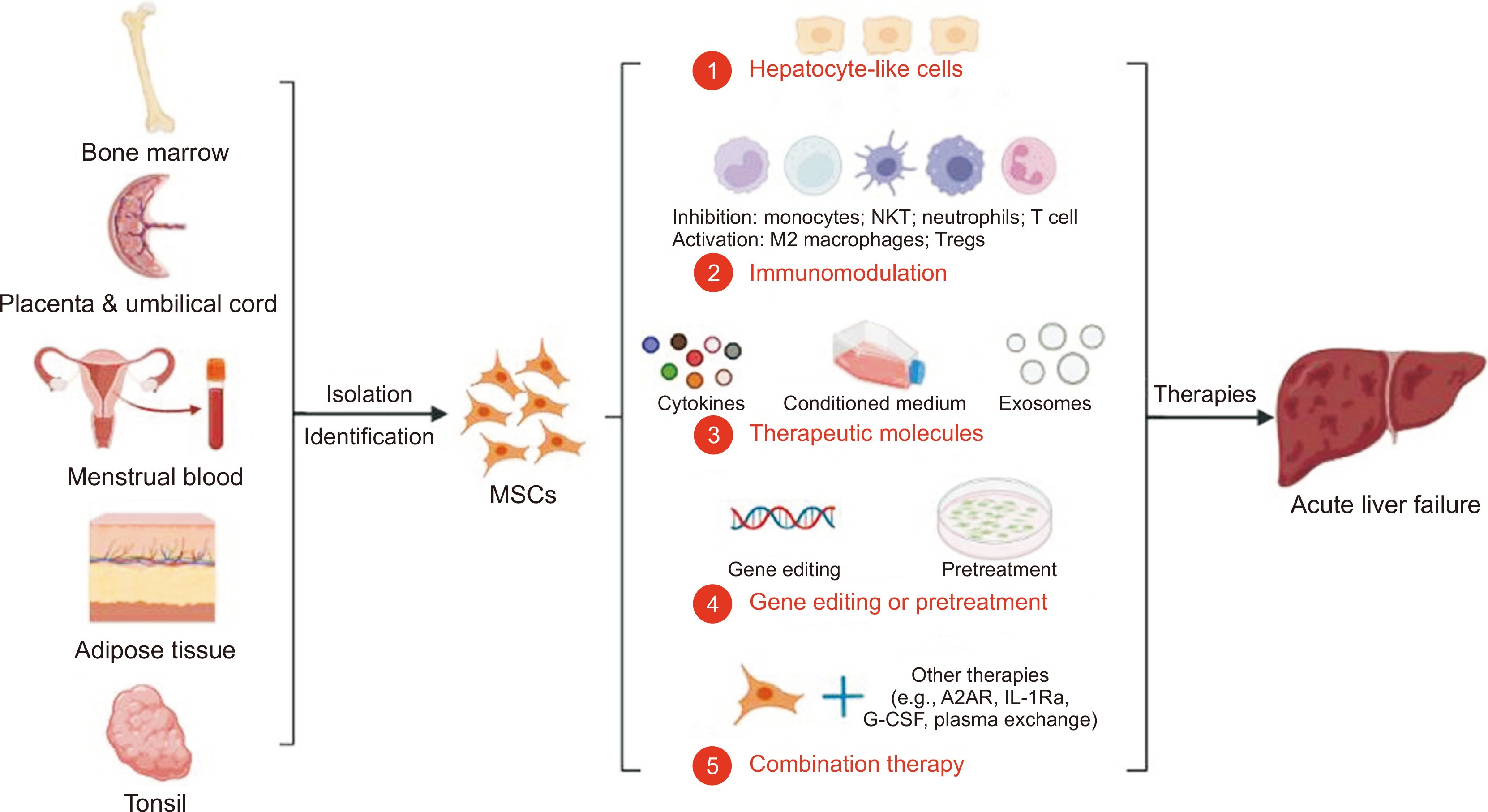
此外,基因编辑或预处理可以增加MSCs中治疗因子的表达,增强MSCs治疗肝衰竭的效果。MSCs主要用作 ALF动物模型的单一疗法,而MSCs在临床试验中与常规疗法联合使用。有趣的是,MSCs与一些治疗因子的结合可以提高动物ALF的疗效。所以,MSCs的联合治疗可能有很好的前景。
目前MSCs治疗ALF的有效性受很多因素影响,包括组织来源、细胞传代、移植途径、移植时间、移植频率、细胞剂量等,因此,MSCs应用于治疗ALF仍有许多困难需要克服。
参考资料:Panpan Yao, Liping Zhou, Lujie Zhu, Binjie Zhou, Qin Yu; Mesenchymal Stem Cells: A Potential Therapeutic Strategy for Neurodegenerative Diseases. Eur Neurol 12 August 2020; 83 (3): 235–241. https://doi.org/10.1159/000509268
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号