卵巢早衰的新疗法是什么?
干细胞疗法。干细胞疗法有望恢复POI患者的卵巢功能和生育能力。干细胞是早期未分化的细胞,具有自我更新、无限增殖和多向分化的能力。
简述
原发性卵巢功能不全 (POI) 是一种罕见的妇科疾病。这种疾病会导致月经失调、不孕和各种健康问题。从历史上看,激素替代疗法是这种疾病的一线治疗方法。被诊断患有POI的女性治疗选择有限。为了弥补这种情况,正在开发新一代的治疗方法,例如体外激活、线粒体激活技术、干细胞和外泌体疗法、生物材料策略和富含血小板的血浆卵巢内输注。然而,这些新兴疗法仍处于实验阶段,需要精确的设计组件来加速它们向临床治疗的转化。因此,每位医生都有责任为个别患者选择合适的疗法。
背景
原发性卵巢功能不全 (POI),也称为卵巢早衰 (POF),与40岁以下卵巢功能丧失有关。它的特点是卵巢卵泡减少,激素分泌减少。尽管之前报道的POI患病率在0.9–1.2%之间变化,但在瑞典进行的一项国家登记研究表明,POI的总患病率约为1.9%。Golezar等人最近进行的一项荟萃分析估计全世界有3.7%的女性受到影响。POI患者会经历长期并发症,例如骨质疏松症、骨折、心血管疾病和抑郁症。此外,这种疾病显示出破坏为人父母的希望和梦想的巨大潜力。
POI的诊断标准包括至少4个月的稀发/闭经和相隔4周以上的两次促卵泡激素 (FSH) 水平升高 (>25IU/L)。延迟诊断POI可能会对患者的生育能力造成不可逆转的损害。抗苗勒管激素 (AMH) 和窦状卵泡计数 (AFC) 是用于评估卵巢储备的其他敏感指标。
卵巢早衰的原因
POI是由遗传因素、自身免疫性疾病、线粒体异常、医源性因素(包括化疗、放疗和外科手术)和环境因素引起的异质性疾病。此外,很大一部分POI患者是特发性的,病因未明。
POI可以通过以下几种方式之一进行处理(图1)。激素替代疗法(HRT)应该被视为雌激素(+孕激素)的生理替代,但它不能恢复卵巢功能。目前使用的新策略主要包括体外激活(IVA)、线粒体激活、干细胞疗法和外泌体治疗、生物材料策略和卵巢内输注富血小板血浆(PRP)。然而,这些有望成为POI突破性疗法的新疗法仍处于试验阶段,在被接受为真正的临床选择之前,必须证明其有效性和安全性。本综述总结了POI的当前和未来治疗策略。
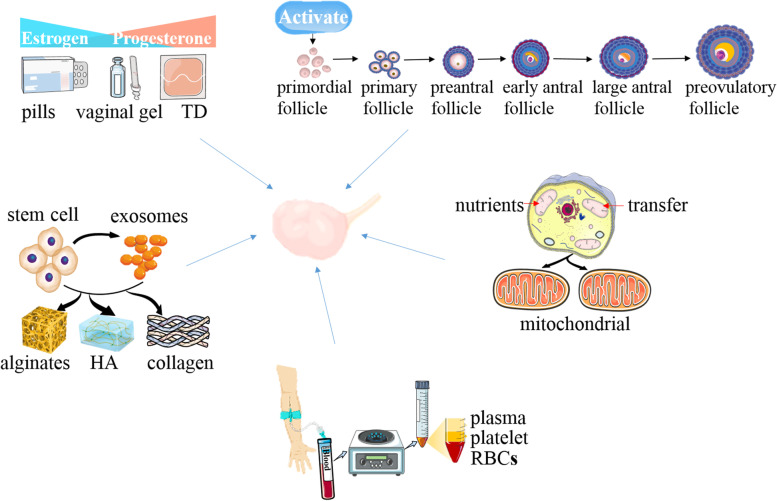
对于POI患者,HRT是一线治疗。体外激活、线粒体激活技术、干细胞和外泌体治疗、生物材料策略和富血小板血浆卵巢内输注是新一代治疗POI的方法
本期主要讲一下干细胞治疗卵巢早衰
干细胞疗法
干细胞疗法有望恢复POI患者的卵巢功能和生育能力。干细胞是早期未分化的细胞,具有自我更新、无限增殖和多向分化的能力。根据其来源,它们分为胚胎干细胞 (ESC)、成体干细胞 (ASC) 和诱导多能干细胞 (iPSC) 。间充质干细胞 (MSC) 是从多种组织中分离出来的ASC的一个子集,包括骨髓、脂肪组织、月经血、脐带、羊水和胎盘。
干细胞治疗卵巢早衰的机制
干细胞通过归巢、分化和旁分泌刺激发挥治疗作用(图2)。自发迁移到受损卵巢的干细胞在多种因素的诱导下粘附和增殖。目前的研究表明,干细胞移植的治疗效果可能是通过旁分泌机制介导的。旁分泌信号涉及周围细胞分泌多种生物活性分子,包括生长因子、细胞因子、调节因子和信号肽,以影响邻近细胞。这个过程通过抗细胞凋亡、抗纤维化、血管生成、抗炎和免疫调节来改善受损卵巢的状况。
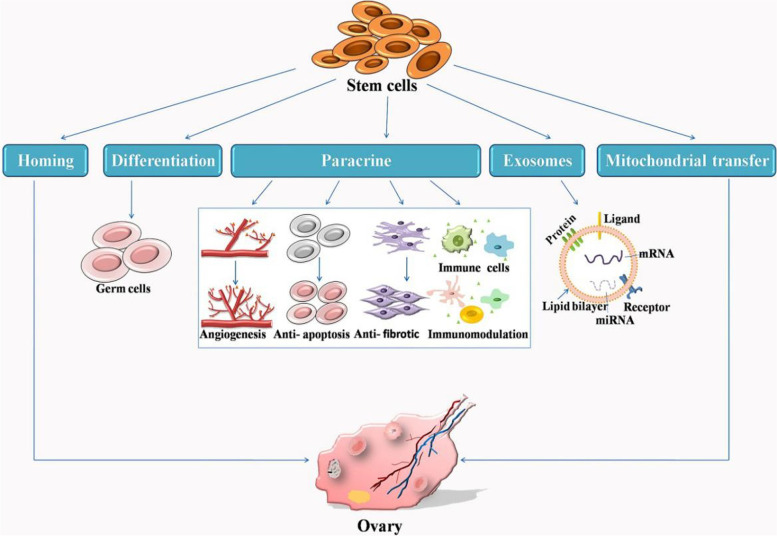
在卵巢功能不全期间,干细胞通过归巢、分化和旁分泌刺激发挥多重作用。旁分泌信号是通过抗细胞凋亡、抗纤维化、血管生成、抗炎和免疫调节来改善受损卵巢的关键。此外,干细胞介导的外泌体和线粒体转移证明了另一种新机制。
对旁分泌信号的进一步研究表明,干细胞外泌体来调节它们的功能。外泌体是携带蛋白质、mRNA和 microRNA(大小为30-130nm)的细胞外囊泡。这些囊泡通过靶细胞内化、配体-受体相互作用或脂质膜融合介导细胞间通讯。根据它们的来源细胞,外泌体可以启动修复和再生过程,以恢复关键的细胞功能并维持组织稳态。
干细胞介导的线粒体转移是近年来发展起来的另一种新机制。线粒体通过隧道纳米管从干细胞转移到相邻细胞,隧道纳米管由驱动干细胞骨骼重排的促炎细胞因子形成。最近也有报道称,炎症驱动的线粒体从干细胞转移到卵母细胞可能会挽救卵母细胞质量和胚胎发育。
卵巢早衰的干细胞疗法
尽管胚胎干细胞显示出无限的分化潜力,但 ESC 的临床应用受到限制。这是因为胚胎干细胞的使用引发了具有挑战性的伦理问题,例如囊胚的破坏。相比之下,通过重新编程人类体细胞制备的iPSC可以在没有任何伦理问题的情况下使用。山城等人证实人类iPSCs可以在体外分化为人类原始生殖样细胞 (hPGCLCs)。更重要的是,在特定条件下培养的hPGCLCs分化为卵原细胞/生殖母细胞样细胞。
间充质干细胞治疗卵巢早衰取得了显着进展(表1)。先前的研究报告称,通过增加血管内皮生长因子 (VEGF) 的分泌,将骨髓干细胞 (BMSCs) 注入小鼠体内可降低FSH水平并增加雌激素水平和卵泡数量。此外,BMSCs可通过下调细胞周期蛋白依赖性激酶抑制剂1A (P21) 和Bcl-2相关X蛋白 (Bax) 以及上调c-myc原癌基因mRNA来抑制 GC凋亡。
| 类型 | 物种和兴趣点模型 | 机制 | 给药方法 | 结果 | 参考 |
|---|---|---|---|---|---|
| iPS细胞 | ICR小鼠 | 微分函数 | 体外培养诱导 | 分化为卵原细胞/生殖母细胞样细胞 | [69] |
| 骨髓间充质干细胞 | 环磷酰胺致兔卵巢功能衰竭 | 增加VEGF的分泌 | 注入耳静脉 | FSH 水平降低 血清雌激素水平和卵泡数量增加 | [70] |
| 骨髓间充质干细胞 | 顺铂诱导胃癌/衰老大鼠细胞凋亡 | 下调P21和Bax,上调c-myc原癌基因mRNA | 体外共培养/通过尾静脉注射 | 抑制GCs凋亡 | [71] |
| 脂肪干细胞 | 顺铂诱导的小鼠卵巢功能衰竭 | 诱导血管生成 | 卵巢内注射 | 恢复了卵泡和黄体的数量 | [72] |
| 男性干细胞 | 表柔比星诱导的GCs 损伤/顺铂诱导的小鼠卵巢衰竭 | 保护GC免于细胞凋亡和增加成纤维细胞生长因子2的分泌 | 体外共培养/通过尾静脉注射 | 改进的兴趣点 | [73 , 74] |
| PMSCs | pZP3诱导的POI小鼠模型 | 减少卵泡闭锁和GCs凋亡 | 经尾静脉注射 | 血清 AMH 和雌激素水平升高 | [75] |
| PMSCs | pZP3诱导的POI小鼠模型 | 通过 PI3K/Akt 信号通路调节 Th17/Tc17 和 Th17/Treg 细胞比例 | 卵巢内注射 | 恢复卵巢功能 | [76] |
| PMSCs | 去卵巢大鼠模型 | 上调的抗氧化因子 | 通过尾静脉注射 | 恢复卵巢功能 | [77] |
| PMSCs | pZP3诱导的POI小鼠模型 | 抑制内质网应激肌醇需求酶 1信号通路 | 通过尾静脉注射 | 减少 GCs 凋亡 | [78] |
| UC-间充质干细胞 | 顺铂诱导的大鼠卵巢衰竭 | 转化生长因子-β/Smad3信号通路 | 通过尾静脉注射 | 调节卵巢基质细胞的分化 | [ 79 ] |
| AFSC | 镀金 | 分化潜能 | 体外共培养 | 体外分化为原始卵泡卵母细胞 | [ 80 ] |
| AMSCs | 环磷酰胺致大鼠卵巢衰竭 | 减少炎性细胞因子的表达 | 通过尾静脉注射 | 抑制卵巢炎症 | [ 81 ] |
| 来自 BMSC 的外泌体 miR-644-5p | 顺铂诱导的小鼠卵巢功能衰竭 | 靶向调控p53 | 通过尾静脉注射 | 抑制GC细胞凋亡 | [ 82 ] |
| 来自 BMSC 的外泌体 miR-144-5p | 环磷酰胺致大鼠卵巢衰竭 | 目标PTEN | 腹腔注射 | 抑制GCs凋亡 | [ 83 ] |
| 来自 BMSC 的 miR-21 | 磷酰胺诱导的GCs凋亡/环磷酰胺诱导的大鼠卵巢衰竭 | 下调 PTEN 和 PDCD4 | 体外共培养/注入双侧卵巢 | 修复卵巢结构和功能 | [ 84 ] |
| ADSC 衍生的外泌体 | 环磷酰胺诱导的小鼠卵巢功能衰竭 | 调节 SMAD 通路 | 注入卵巢 | 卵子发生和颗粒细胞的增殖 | [ 85 ] |
| 来自 hUC-MSC 的外泌体 miRNA-17-5p | 环磷酰胺诱导的小鼠卵巢功能衰竭 | 调节SIRT7信号通路 | 注入卵巢 | 改善卵巢功能 | [ 86 ] |
| 来自 AFSC 的外泌体 miR-10a/ 和 miR-146a | 环磷酰胺诱导的小鼠卵巢功能衰竭 | 抑制性卵泡闭锁 | 移植到卵巢 | 增加 GC 存活率 | [ 87 ] |
| 从人类 AMSCs 释放的外泌体 miR-320a | 环磷酰胺诱导的小鼠卵巢功能衰竭 | 受监管的 Sirtuin4 | 注入卵巢 | 延迟 POI 中的 ROS 生成 | [ 88 ] |
| 胶原支架+脂肪干细胞 | 雷公藤多苷致大鼠卵巢功能衰竭 | 增强脂肪干细胞在靶器官中的保留 | 注入卵巢 | 增加卵泡数量 | [ 89 ] |
| 胶原支架+ UC-MSCs | POI患者 | FOXO3a 和 FOXO1 的磷酸化 | 卵巢内注射/ | 激活休眠卵巢中的卵泡 | [ 90 ] |
| 藻酸盐+脂肪干细胞 | 老鼠 | 分泌细胞因子 | 体外共培养 | 支持体外卵泡发生、存活和成熟 |
脂肪来源的干细胞 (ADSCs) 具有多能性且易于获取,是理想的治疗细胞。一项研究表明,ADSC植入可诱导血管生成,恢复卵泡和黄体的数量,从而修复卵巢损伤。
月经血来源的间充质干细胞 (MenSCs) 越来越受到关注,因为有关其使用的非伦理性质的争议,以及低免疫排斥和毒性。之前的研究表明,MenSCs保护GCs免于凋亡并增加成纤维细胞生长因子2的分泌,从而改善POI。
此外,胎盘来源的间充质干细胞 (PMSCs) 移植可显着增加血清AMH和雌激素,同时显着减少卵泡闭锁和 GC凋亡。
根据最近的研究结果,PMSCs缓解POI的潜在治疗机制可能包括:
- 通过PI3K/Akt信号通路调节Th17/Tc17和Th17/Treg细胞比例来恢复卵巢功能;
- 抗氧化因子的上调,这已被证明可以恢复去卵巢大鼠的卵巢功能;
- 通过抑制内质网应激肌醇需求酶1信号通路减少GC凋亡。
脐带间充质干细胞 (UC-MSC) 广泛用于治疗POI。人UC-MSCs通过转化生长因子-β/Smad3信号通路调节卵巢基质细胞的分化,从而抑制POI大鼠的卵巢纤维化。
此外,人羊水干细胞 (AFSC) 已显示出在体外分化为原始卵泡卵母细胞的潜力。羊膜间充质干细胞 (AMSCs) 也减少了炎症细胞因子的表达,从而抑制了POI大鼠的卵巢炎症。使用低强度脉冲超声预处理AMSCs,增强抗炎作用。
卵巢早衰的无细胞疗法
用外泌体治疗POI具有更高的临床安全性,因为使用外泌体可以避免免疫排斥以及血管阻塞和肿瘤突变的风险。最近的一项研究表明,源自BMSC的外泌体miR-644-5p靶向调节p53以抑制GC的凋亡,从而减轻POI。
2020年,杨等人报道了BMSCs衍生的外泌体miR-144-5p通过靶向PTEN抑制GC凋亡来缓解POI。此外,miR-21(一种调节BMSC细胞凋亡的关键miRNA)的过表达通过下调PTEN和程序性细胞死亡蛋白4(PDCD4) 修复了大鼠的卵巢结构和功能。
卵巢早衰的生物材料策略
干细胞移植会导致极度的细胞损失。因此,必须引入包括胶原蛋白、藻酸盐和透明质酸 (HA) 在内的生物材料。胶原蛋白对于维持生物活性至关重要。
他等人。通过微流体封装创造了富含胶原蛋白的仿生3D壳,其中用这些仿生胶囊培养的卵泡帮助它们发育到胃窦阶段。苏等使用胶原蛋白支架来增强脂肪干细胞在靶器官中的保留。
同样,丁等人据报道,胶原支架上的UC-MSCs通过FOXO3a和FOXO1的磷酸化激活卵泡。
干细胞治疗的安全性和优化措施
必须评估干细胞的安全性,以便在临床应用之前对其进行标准化。ESC和iPSC的致瘤性、免疫原性和异质性通常限制了它们的应用。其中,致瘤性是最令人担忧的问题。与肿瘤发生相关的因素如下:
- 干细胞群中存在的残留未分化和/或未成熟细胞导致不正确的模式化;
- 诱导iPSCs特异性的重编程因子促进肿瘤发生;
- 体外干细胞扩增诱导的基因突变可能导致致瘤性。
因此,确保定向分化的有效方法、严格的纯化程序和细胞系的仔细选择对于该疗法的安全性具有重要意义。
在免疫原性方面,自体干细胞移植是消除排斥反应的理想选择。然而,由于时间和成本限制,同种异体移植优于自体移植。
在世界范围内进行的临床试验表明,具有低免疫原性和致瘤性的MSCs是干细胞的安全来源。然而,这些细胞的治疗效果仍然受到多种因素的影响,例如体外扩增的细胞产物的质量和数量、注射途径、最佳剂量和治疗时机。迄今为止,研究人员和临床医生未能有效解决这些问题。
结论
POI患者有需要特别注意的独特需求。以挽救卵巢功能为重点的不同治疗策略为患有POI的女性开辟了新的机会。有关相关领域各个方面的知识将提高治疗这种疾病的可能性。在优化POI管理之前需要解决几个问题。具体而言,HRT仍然是治疗POI的核心要素。临床医生有责任告知患者未经治疗的POI可能会增加过早死亡和心血管疾病的风险,并应在决策过程中考虑患者的病情、需求和偏好,根据需要调整剂型、剂量和使用时间。
干细胞疗法已显示出对POI有希望的结果。利用外泌体替代细胞本身足以克服干细胞的肿瘤发生和免疫原性。重要的是,各种生物材料可用于递送干细胞或外泌体,以提高干细胞或外泌体在靶器官中的保留率和存活率。未来的研究方向似乎倾向于外泌体与天然生物材料结合的应用。
参考资料:Huang QY, Chen SR, Chen JM, Shi QY, Lin S. Therapeutic options for premature ovarian insufficiency: an updated review. Reprod Biol Endocrinol. 2022 Feb 4;20(1):28. doi: 10.1186/s12958-022-00892-8. PMID: 35120535; PMCID: PMC8815154.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号