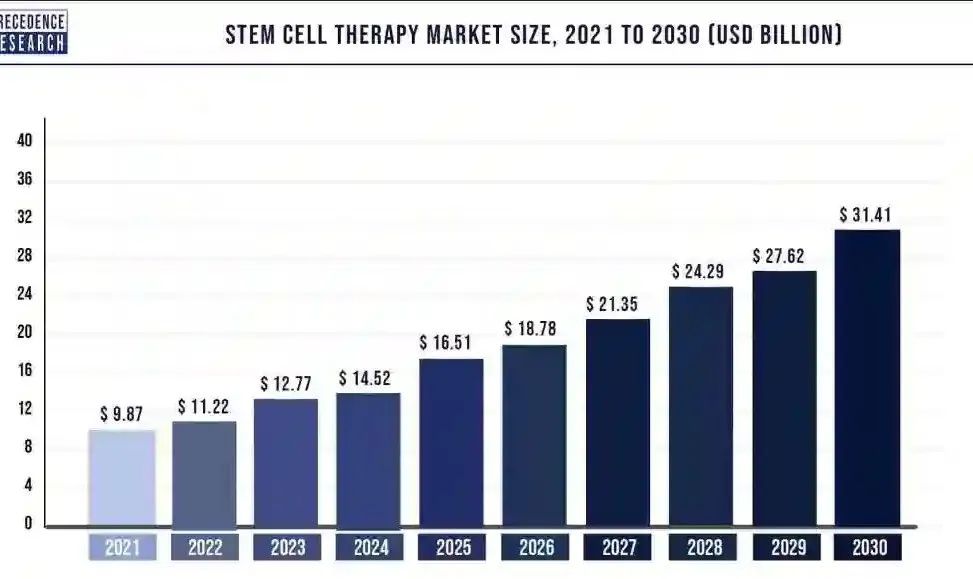
干细胞已经成为当今生物医学最热门的研究领域之一,并在越来越多的疾病领域发挥重要作用,未来发展潜力巨大。据Precedence Research数据,2021年全球干细胞治疗市场规模为98.7亿美元,预计到2030年将达到314.1亿美元左右,并有望在2022年至2030年的预测期内以13.73%的复合年增长率(CAGR)增长。
干细胞巨大的潜力和良好的市场前景,使得全球干细胞研究如雨后春笋一般蓬勃发展,根据ClinicalTrials.gov数据,目前全球登记的干细胞临床研究项目已经超过6000项,主要集中在心血管系统疾病、糖尿病、退行性疾病、自身免疫性疾病等领域。
大量的资金涌入推动着干细胞行业迅速发展,但由于缺乏统一标准,且干细胞作为一种新兴治疗技术,需要更多的临床数据来验证其临床疗效。在这一背景下,许多国家高度重视干细胞行业的发展并出台了一系列的法规,进而规范和促进干细胞行业的发展。
干细胞行业的法规
国内法规
随着全球干细胞行业的飞速发展,“细胞治疗及临床转化”成为我国“十四五”健康保障发展的重大课题。国家多个相关部委及地方政府陆续颁布一系列利好政策,从临床研究到产业发展,为行业发展新格局营造了良好的环境,也为干细胞创新技术和产品的转化落地带来新的机遇。
通过梳理我国干细胞治疗相关的政策和法规,可以看到,药监部门、卫健部门等在近几年出台了多项与干细胞治疗相关的指导文件,其中最具代表性的文件包括2016年11月出台的《“十三五”国家战略性新兴产业发展规划》,2017年出台的《细胞治疗产品研究与评价技术指导原则(试行)》以及2020年出台的《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》等。

总的来看,我国明确干细胞按药品、技术管理的“双轨制”监管,企业主导研制细胞制剂鼓励按药品申报,由国家药品监督管理局(NMPA)按照药品进行监管,企业开展临床试验需要按照药物临床试验相关要求提交申请。
国内干细胞监管法规严格强调干细胞临床前研究和干细胞的安全性,2015年发布的《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》认为,细胞疗法制备过程中良好的制造规范(GMP)以及严格的审查流程,反对为了抢占干细胞治疗领域的研发优势而放松对干细胞临床试验的审查力度。
此外,2017年发布的《细胞治疗产品研究与评价技术指导原则(试行)》认为干细胞药品应遵循良好的生产制造规范,只有充分证明了安全性和有效性后,才能进行人体研究且相关研究需在严格的监管下进行,这与国际干细胞研究学会2016年颁布的《干细胞研究与临床转化指南》思想一致。
国外法规
事实上,国内干细胞法规的制定充分借鉴了干细胞技术相对先进国家的法规和政策,包括日本、欧美等,下面便对日本和美国干细胞行业法规做一个简介。
➤日本干细胞法规
日本自1981年开始积极探索干细胞行业,至2014年年底,日本开始实施《再生医学安全法》和《药品和医疗器械法》,逐步完善了干细胞双轨制监管体系。
通过分析日本监管法规可以发现,日本干细胞采取医疗技术和新药双轨制监管,通过设立职责明确的监管机构、制定分类别的法律法规、打通全流程的监管审批步骤,构建了两条完整的监管轨道。

在医疗机构执行的临床研究和应用,被认定为医疗技术的干细胞疗法,由日本厚生劳动省按照《再生医学安全法》进行监管。由企业开发且以取得上市销售许可为目的的干细胞新药,须经日本PMDA审查,按照《药品和医疗器械法》进行注册试验和上市审批。这些法规彻底打通了干细胞技术和药品的两条路径,干细胞产品研发和上市的路径更加通畅。
➤美国干细胞法规
FDA对于干细胞行业采用经典的“法规-监管-指导原则”三级监管体系,并将干细胞产品归属于人体细胞、组织及基于细胞、组织的产品(HCT/Ps)。作为干细胞临床试验数量最多,上市产品最多的国家,美国制定了规范具体的干细胞研究监管依据,覆盖干细胞产品研发到上市的整个周期。

按照风险等级,干细胞产品被分为需要和不需要上市审批两种类型:仅受《公共卫生服务法案》(PHS)第361条规定的干细胞产品不需要上市前审批,但需上市前在FDA注册。符合《公共卫生服务法案》(PHS)第351条规定范围的产品必须按照研究型新药申报临床试验(IND),并需上市前审批(BLA)。综合来看,FDA对于干细胞产品的监管着重于干细胞产品的供体来源、原材料质量、生产工艺过程控制和产品的深度质量分析。
随着干细胞行业的蓬勃发展,各国干细胞法规的建设已经相对完善,国内干细胞法规已经进入到全面规范阶段,这也对企业的干细胞产品提出了更高的质量要求,而GMP生产则是满足企业干细胞产品质量需求的重要一环。
干细胞的GMP生产
干细胞的GMP是一种涵盖干细胞产品整个生命周期的体系,包括从生产到应用的所有环节,其重要内容包括获取干细胞、干细胞产品的制造,干细胞质量控制。该体系可确保生产商一致地生产医药产品,并根据产品规范的要求,按照适合其预期用途的质量标准进行控制。
获取干细胞
获取干细胞是干细胞产品生产的起点和重要步骤,其目的是为了获得单一类型干细胞。在干细胞产品制备过程中,由于原代分离的细胞往往是多重类型细胞的混杂,干细胞有时也不是一个均一的群体,研究人员往往通过分离纯化来获得高纯度、一致性的干细胞。而随着干细胞技术的不断发展,干细胞的创新方向也出现了一些更新迭代,目前诸多企业会通过细胞工程技术对原始干细胞进行改造,从而扩宽治疗用途,其中CRISPR介导的基因编辑技术便是改造干细胞的重要工具。
目前CRISPR介导的基因编辑技术已经在干细胞领域展现出了重要作用,但基因组编辑过程通常会损害细胞活力,且细胞筛选和验证过程仍是当今克隆工作流程中不可或缺的一部分,但其缺乏有效分离和表征工程改造细胞的工具被认为是这些应用中的一个重要瓶颈。在通过CRISPR进行细胞改造时,细胞通过非同源末端连接进行修复,这个容易出错的过程,通常会导致脱靶、单等位基因修饰和未编辑等非同质细胞产生。因此,在使用前,必须对细胞进行分离并克隆鉴定,确保其克隆性和谱系可追溯性,这不仅对制药、细胞治疗等非常重要,也是EMA和FDA监管要求所强制执行的。
但目前常用的许多方法都难以满足药企的个性化需求,通过有限稀释和流式分选等方法细胞存活率低、缺少克隆性的依据,不能有效处理小批量样本,且具有较高的交叉污染风险。而Cytena的UP.SIGHT克隆筛选单细胞打印系统分选温和且速度快,该产品能通过在细胞轻轻的沉积在孔板之前筛选出单个细胞和细胞形态,确保细胞的活力,其一次性的、无菌的打印墨盒避免了交叉污染,此外,该产品能在细胞沉积的过程中提供单细胞的图像,提供细胞系是来自于单克隆的证据,大大简化进而提升干细胞产品的开发进程。

干细胞产品制造
为满足干细胞的GMP生产要求,干细胞产品的制造应建立全过程或全生命周期质量保证和控制体系,生产过程应进行严格的工艺验证,并建立明确的关键控制点,此外,在生产过程中应特别注意人员、环境、设备等的要求。

为获得一致性和高质量的干细胞产品,制造商须进行工艺开发和验证,以证明制造工艺的可行性和稳健性,控制的每个工艺生产步骤以确保成品符合所有质量属性。工艺过程设计应该避免细胞发生非预期或不正常的变化,并满足消除相关杂质的要求。一次性大规模制备干细胞产品是干细胞技术发展的趋势所在,为了能够按照GMP标准进行大规模生产,需要一个完全封闭、可控制和可扩展的培养系统,此时可以采用大规模培养的生物反应器。不同生物反应器都有其特定的特点,根据产品特点和成药需求选择最佳的生物反应器对于大规模生产高质量干细胞产品非常重要。
质量控制
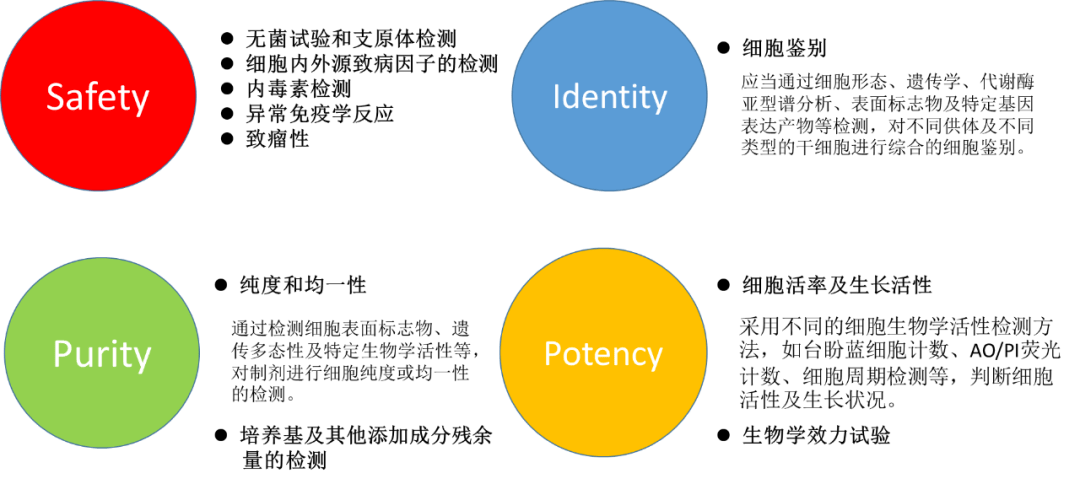
基于干细胞的疗法被认为是先进的治疗药物产品,其GMP质量控制贯穿整个开发和规模化生产过程。干细胞质量控制涵盖了细胞功能、纯度和安全性等多方面,各国在质量控制标准方面略有差异。国内对于干细胞产品的质量控制包括四个大的方面,分别为安全性(Safety),纯度(Purity),潜能性(Potency)以及均一性(Identity)。
而美国FDA对于干细胞的质量控制内容则相对更为全面,其干细胞质控覆盖了干细胞产品从研发到上市整个周期。FDA仅接受采用单克隆细胞生产生物药,其政策和法规都强制要求生物制药企业提供证据以证明细胞的单克隆源性。针对此,UP.SIGHT将具有高效、快速和温和的单细胞分选技术与超快速、高质量的成像系统相结合,可实现喷嘴成像和3D全孔成像,在分离细胞的前后过程会连续拍取多张细胞图片并储存在磁盘中以便追踪,为单细胞克隆性提供直接的证据。

总的来看,干细胞质控重点在于安全性、有效性,有必要为干细胞产品建立一套质量标准和质量控制程序,进而保证干细胞产品符合国家药监局批准的药品质量标准。而UP.SIGHT通过自动化方式替代劳动密集和耗时的步骤来简化干细胞开发的工作流程,在保障干细胞产品质量的同时简化流程,提升工作效率。

结语
干细胞治疗已经成为当下最为热门的赛道之一,武田、拜耳等跨国巨头纷纷在这一赛道下重注。目前干细胞最令人关注的应用前景是用于重大慢性疾病、疑难杂症、和抗衰老以及组织修复。在政策加持和大量临床需求推动下,干细胞行业或将迎来较好发展机遇,截止目前,我国共有超过30多款MSC新药临床试验申请获得受理,超过25个项目已经获批临床默示许可,随着政策不断放开,技术不断成熟,我国干细胞行业有望加速发展。
内容来源:医麦客,侵权即删!
参考资料:
1.PrincipalCriteriaforEvaluatingtheQuality,SafetyandEfficacyofhMSC-BasedProductsinClinicalPractice:CurrentApproachesandChallenges.
2.Pharmaceutics.2019Oct;11(11).pii:E552.doi:10.3390/pharmaceutics11110552.
3.https://stemcellsjournals.onlinelibrary.wiley.com/doi/10.1002/sctm.21-0083
4.PrecedenceResearch
5.CDE官网
6.王泽,宋扬,秦林伟.干细胞的研究进展和应用前景[J].沈阳师范大学学报(自然科学版),2021,39(06):566-570.
7. https://stemcellsjournals.onlinelibrary.wiley.com/doi/10.1002/sctm.21-0083




 浙公网安备 33010202002429号
浙公网安备 33010202002429号 官方微信公众号
官方微信公众号